肿瘤坏死因子alpha(TNF-α)是一种由157个氨基酸组成的 17-kDa 蛋白质,为免疫细胞产生的多功能细胞因子,在细胞凋亡和存活以及免疫和炎症中发挥关键作用[1]。
它主要由活化的巨噬细胞、T 淋巴细胞和自然杀伤 (NK) 细胞分泌,但是在包括成纤维细胞,平滑肌细胞和肿瘤细胞中也会有少量表达。肿瘤及其浸润细胞在肿瘤微环境 (TME) 中释放的炎性介质已被广泛认为是癌症的标志之一。有证据表明低浓度的促炎细胞因子表达与癌症的严重程度以及不良预后相关。
TNF-α作为主要的炎性介质已被发现在妇瘤、消化系统肿瘤、泌尿系统肿瘤以及血液瘤中表达。在 20 世纪 70 年代后期人们发现TNF-α即具有抑制肿瘤细胞增殖,又具有诱导肿瘤生长的双刃剑效应[2]:他一方面可以通过诱导癌细胞凋亡去抑制肿瘤细胞生长,但另一方面也刺激大多数对TNF诱导的细胞毒性具有抗性的癌细胞的增殖、存活、迁移和血管生成,从而导致肿瘤的发展发生。
一,TNF-α信号通路
TNF-α 通过两种不同的受体发挥作用[3]。
TNF受体1(TNFR-1) (p60) 在所有细胞类型上表达,而TNF受体2 (TNFR-2) (p80) 局限在免疫细胞中表达。尽管TNF-α 对TNFR-2的亲和力比对 TNFR-1高五倍,但TNFR-1才是启动 TNF-α 大部分生物活性的关键[4]。两种受体之间的主要区别在于只有TNFR-1即具有转导细胞存活信号的能力亦有诱导细胞凋亡能力,但这种生死信号调节的作用机制至今也未被透彻理解[5]。
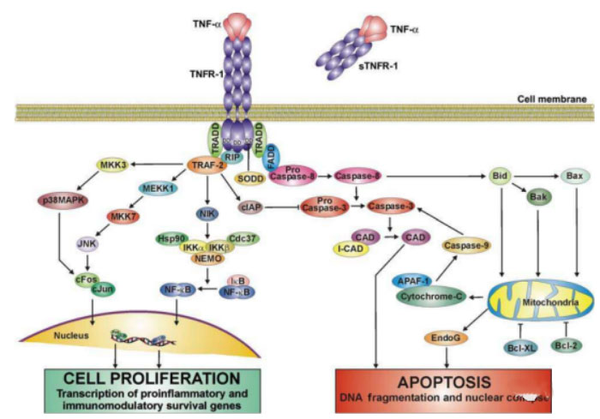
如图1所示,当TNF-α与TNFR-1受体结合后,会招募TNFR相关死亡区域蛋白 (TRADD),衔接蛋白受体相互作用蛋白(RIP),TNFR相关因子2 (TRAF-2)和Fas相关因子死亡区域蛋白 (FADD) [6]。而这些衔接蛋白负责进一步细胞内信号传导。当TNFR-1 发出细胞凋亡信号时,FADD被募集到复合物中,启动导致细胞凋亡的蛋白酶级联反应,最终导致细胞中DNA被切割,造成细胞凋亡[7]。当TNFR-1发出生存信号时,TRAF-2被募集到复合物中,在一系列蛋白酶激活后,通过细胞质凋亡蛋白抑制剂抑制细胞凋亡(cIAP)[8]。
而TRAF-2及RIP主要参与TNF诱导的 NF-κB 激活,而 NF-κB的靶基因以及其诱导的抗氧化锰超氧化物歧化酶 (MnSOD) 均被发现可以抑制细胞凋亡,在细胞的发生发展中起到关键作用,也同样促进癌细胞的生长[9]。
二,TNF-α造成的肿瘤杀伤
TNF 在1975年被发现并于1984年成功克隆,因其高浓度注射到小鼠移植肉瘤中可以诱导肿瘤坏死而得名[10]。这种现象后被证实与 TNF 连接 TNFR1 时可以触发肿瘤内皮细胞凋亡的能力相关[11]。但由于TNF治疗引发的高毒副作用,很长时间无法在临床上应用,直到两个研究小组发现将高浓度的 TNF 灌注到黑色素瘤或肉瘤患者的孤立肢体上可以造成细胞杀伤且降低TNF治疗带来的不良反应[12]。
这些研究使得TNF的应用策略转变为针对肿瘤细胞毒性的增强。例如一项在小鼠黑色素瘤和淋巴瘤模型中证明基因工程改造的TNF能够通过抗肿瘤血管生成来抑制肿瘤生长[13];另一项研究证明对小鼠黑色素瘤内注射TNF和 IL-2 编辑的溶瘤病毒也增强了PD-1 抑制剂的疗效[14]。
但TNF 对免疫激活的直接影响在多数情况下都是有限的,最近的一项动物研究表明,在过继性T细胞转移疗法(ACT)中,由CD4+ T细胞产生的TNF只有与化疗药物联用时才能对小鼠的淋巴瘤,结直肠癌以及乳腺癌造成肿瘤杀伤[15],因此抗原特异性 CD4+ T 细胞产生的TNF和化疗抑制小鼠肿瘤且延长其生存的必备条件。
这些研究表明,即使在大量抗原特异性T细胞可以到达肿瘤的情况下,他们产生的TNF水平仍不足以杀死肿瘤细胞。目前TNF-α在肿瘤治疗的发展方向多以重组形式与化疗联合用于肢体隔离热灌注术(ILP)为主[16]。重组TNF-α在 ILP 中可以直接抑制肿瘤生长,且增加化疗药物对肿瘤组织的渗透。
因此TNF-α在治疗肿瘤领域的发展方向多以作为促进剂而非直接参与肿瘤治疗,目的是利用该药物增加药物输送能力,因为这种细胞因子在肿瘤内的选择性靶向以及毒性管理仍是待探究的问题。
三,TNF-α造成的肿瘤生长
F.Balkwill 教授是第一个直接将TNF与肿瘤生长联系起来的,他观察到在小鼠皮肤癌变模型中,TNF、TNFR1 和 TNFR2 的缺失可以显着减少乳头状瘤的发展。目前已被证实在较低区间内的高水平TNF-α表达会促进肿瘤生长。在B16小鼠黑色素瘤模型中,癌细胞分泌的TNF 促进了肿瘤对骨髓细胞的浸润以及内皮标志物的表达,从而促进肿瘤血管化和进展[17]。而体内研究表明使用靶向抗体阻断 TNF/TNFR1 信号通路能够增加微环境中黑色素瘤特异性 CD8+ T 细胞的比例并延缓肿瘤生长[18]。
另外,研究发现肿瘤相关TNF还可以影响癌细胞的分化。在接受 ACT 治疗的黑色素瘤患者中观察到TNF诱导肿瘤分化过程,减少黑色瘤生物标记物、降低免疫原性,促进肿瘤复发[19]。
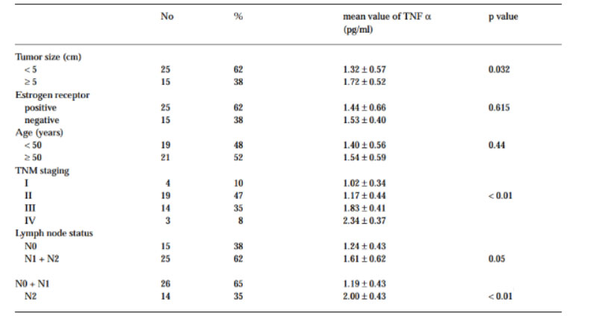
一项纳入40例浸润性乳腺癌患者前瞻性研究对比了患者血液样本与30例相同年龄的健康女性血液样本。研究表明浸润性乳腺癌患者血清TNF-α平均值为1.47±0.58 pg/ml,比对照组的0.98±0.37 pg/ml显著升高(P < 0.01)。且单变量分析显示在肿瘤最大直径≥5cm(P=0.03),TNM分期更晚(P<0.01)以及更晚期的淋巴结状态 (P < 0.01) 的患者中血清TNF-α显著升高[20](表1)。而在包括了肺癌和肾细胞癌的其他癌症模型中也观察到 TNF 参与上皮-间质转化 (EMT),诱导肿瘤分化从而促进肿瘤发生[21-22]。
表1:与临床病理变量相关的 TNF-α 血清浓度
总之,在癌症进展过程中,TNF 不仅可以通过直接调节白细胞的活化、功能和存活去降低免疫疗法的效果,还可以改变癌细胞的表型,使它表达免疫抑制分子以及对 T 细胞不可见,帮助免疫逃逸。
四,TNF-α对肝细胞癌的影响
肝细胞癌 (HCC) 是一种与炎症相关的疾病。HCC 的发展和进展受遗传、表观遗传和环境因素的影响。乙型肝炎病毒(HBV)和丙型肝炎病毒(HCV)是HCC 最普遍的危险因素之一。大约 70%-80% 的 HCC 与持续性病毒感染有关。
而巨噬细胞分泌的TNF-α作为一种促炎细胞因子,在恶性疾病的发病机制中发挥关键作用。一项大鼠动物研究发现 TNF-α直接参与HPC的激活,而HPC的激活通常与肝损伤的组织修复相关。因此TNF-α抑制和缺失可以通过增加肝细胞凋亡和减少肝细胞增殖来降低肿瘤发生率[23](图2)。
而另一项收集了120例肝细胞癌患者的研究将临床诊断分为复发组和未复发组以观察IHC检测的TNF-α表达,结果显示复发组TNF-α表达水平显著高于未复发组[24]。(0.25±0.01 vs 0.15±0.01, P<0.001,图3A). 另外分析肝门区 p-STAT3 表达与肿瘤周围组织 TNF-α之间的关系表明这两组之间存在显着正相关(P<0.01,r=0.452,图 3B)。因此TNF-α与促进肿瘤生长以及导致HCC的不良预后息息相关。
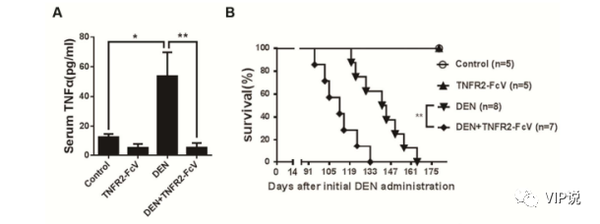
图2:A 和 B. 免疫荧光染色显示,EpCAM (A) 和 OV6 (B) 阳性在肝门区域的表达均因 DEN 处理(移植HCC细胞小鼠)而增加,而 DEN+TNFR2-FcV组(移植HCC细胞但同时做TNF抑制处理)的两种标记物水平较低,这表明 HPC 激活可能需要 TNF-α。
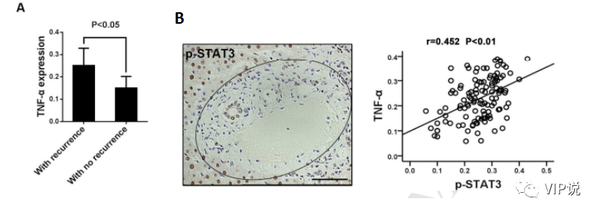
图3:A. IHC检测的瘤周组织TNF-α表达,结果显示复发组TNF-α表达水平高于未复发组。B.随着肿瘤周围组织中 TNF-α 表达的增加,肝门区的 p-STAT3 表达增加。
五,高TNF-α表达影响肝癌靶向药疗效
体外实验表明TNF-α通过诱导上皮-间质转化(EMT)促进肝癌细胞对索拉非尼耐药。且目前的研究表明索拉非尼对 TNF-α 的表达和分泌没有显着影响,无法逆转高 TNF-α 表达对于HCC 细胞中EMT诱导作用。
一项纳入 62 例HCC患者术后介绍索拉非尼辅助治疗的研究中分析了 TNF-α表达与预后的相关性。研究发现高 TNF-α表达的HCC患者无复发生存期及总生存期均较低TNF-α表达的HCC患者更短[25]。

图4:Kaplan-Meier 分析表明具有较低 TNF-α表达的 HCC 患者总生存期和无复发生存期均较差(n=62)
六,淫羊藿素软胶囊可降低TNF-α表达
淫羊藿素软胶囊为传统中药材提取的黄酮类化合物,是拥有全球自主知识产权的1.2类中药创新药,是一种新型的小分子免疫调节剂。它独特的双通道免疫调节机制可以:1.通过抑制JAK2和STAT3磷酸化抑制IL-6/JAK2/STAT3信号通路,下调IL-6及TNF-α水平;2.通过直接结合MyD88/IKKα,抑制TLR- MyD88-IKK-NFκB信号通路,从而减少TNF-α、IL-6等因子产生,进一步下调IL-6/JAK2/STAT3信号通路,两条通路相辅相成,通过调节体内促炎性因子水平来调节肿瘤免疫微环境。而TNF-a 与 IFN-γ是作为综合生物标志物评分(CBS,composite biomarker score)中的两个细胞因子,也和其他标志物共同参与到阿可拉定 II-III 期临床研究中的 HCC 疗效预测部分。
研究表明,在富集人群中(满足以下检测指标的至少两项:①AFP ≥ 400ng/mL ②TNF-α<2.5 pg/mL ③IFN-γ ≥ 7.0pg/mL。),淫羊藿素组的中位总生存期为13.54个月,Harzard ratio为 0.43,死亡风险比对照组降低57%。独立影像学评估的试验组患者中位至疾病进展中位时间也比对照组延长了近一倍,为3.65个月,中位无进展生存期为2.79个月。且不良反应发生率极低,3级以上总不良反应发生率不到10%。根据该III其研究结果,淫羊藿素软胶囊被2022版CSCO肝癌诊疗指南推荐用于晚期肝癌的治疗(1B类证据),且对于肝功能较差的患者中获得了CSCO指南的Ⅰ级推荐(1B类证据)。
七,逐典肿瘤坏死因子alpha(TNF-α)特点:
1.高纯度;2.高特异性;3.无动物源(AOF);4.GMP级别;5.无His标签
实验数据:
SDS-PAGE鉴定和SEC-HPLC纯度:还原的SDS-PAGE 未见杂蛋白(左);SEC-HPLC显示高纯度大于 98%,无聚集体产生(右)

SDS-PAGE鉴定和SEC-HPLC纯度图
应用案例:
TNF-α活性:
在放线菌素D存在下通过鼠L929细胞的细胞溶解测定的ED 50 ≤ 0.05 ng/ml,对应比活性≥ 2 x 10 7units/mg。
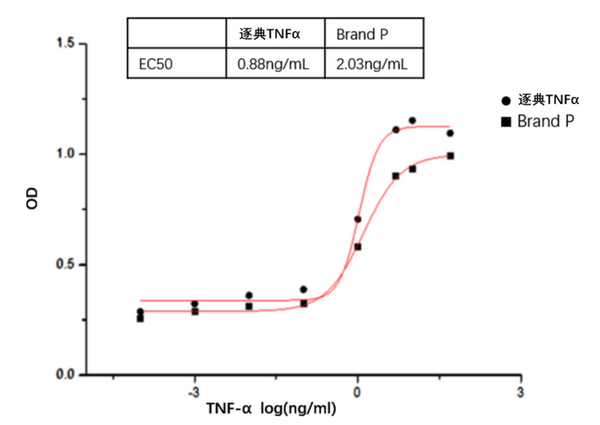
TNF-α浓度与鼠L929细胞OD关系




