本文来源于微信公众:眸析实验室 作者:眸析实验室
分享一篇肿瘤疫苗的文章,在肿瘤原位将肿瘤细胞转变为抗原提呈状态,以激活肿瘤内T细胞发挥抗肿瘤作用。巧妙之处在于靶向降解PD-L1的同时将外源抗原肽引入细胞内,促进肿瘤细胞提呈该抗原肽,既解除了免疫抑制,又提呈抗原激活了T细胞。具体内容如下:
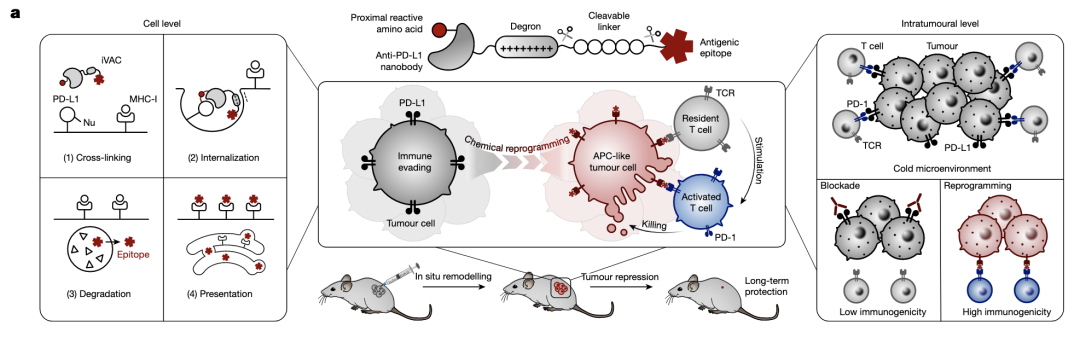
iVAC设计示意图:靶向降解PD-L1的同时引入抗原肽进入细胞,加工提呈给T细胞。
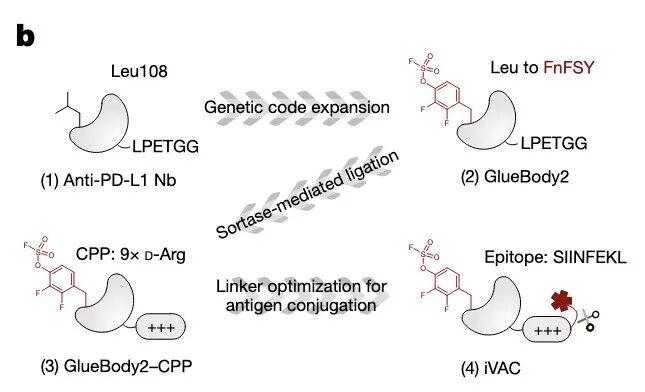
iVAC结构:Gluebody2结合PD-L1,偶联CPP穿膜肽实现靶向降解,通过Sortase A连接OVA肽,实现抗原提呈。
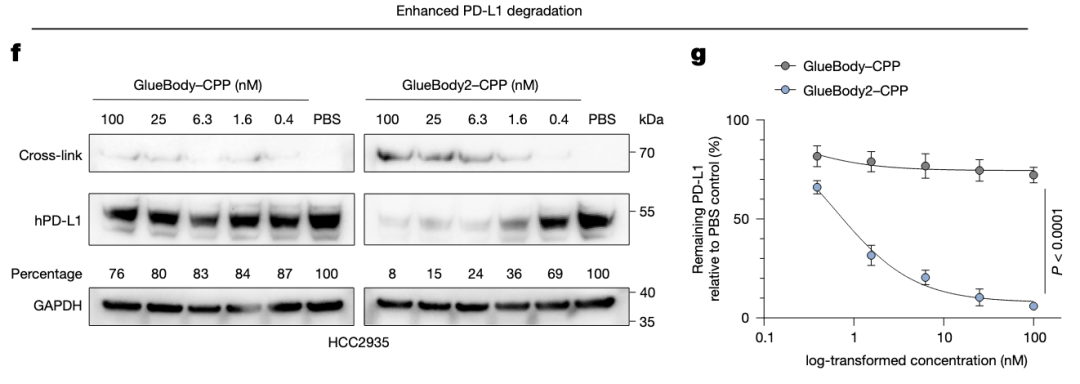
验证PD-L1降解。
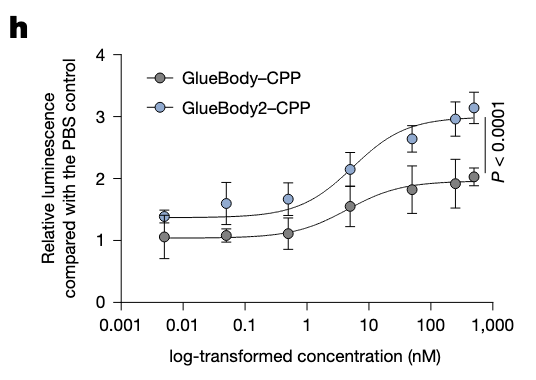
验证T细胞激活。
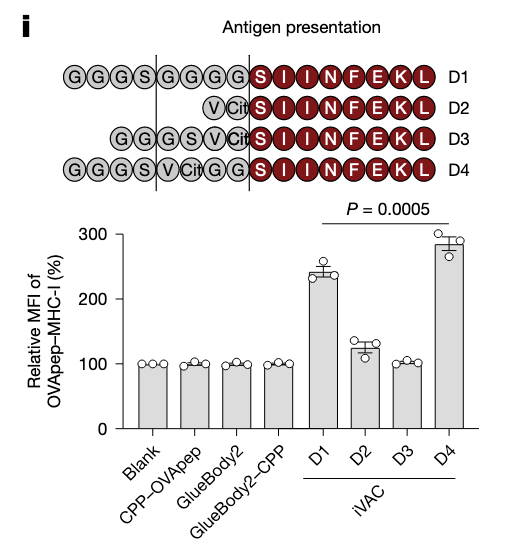
不同linker进行筛选。D4使得抗原肽的加工提呈最佳。
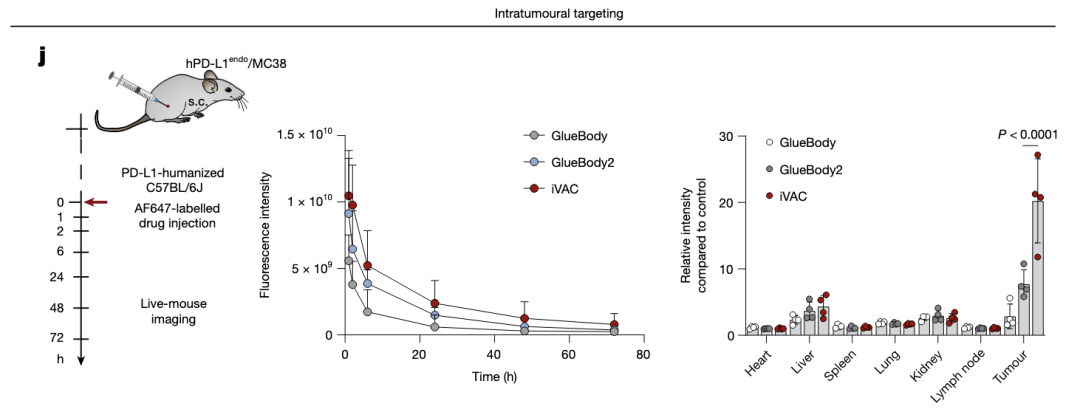
iVAC可靶向肿瘤。
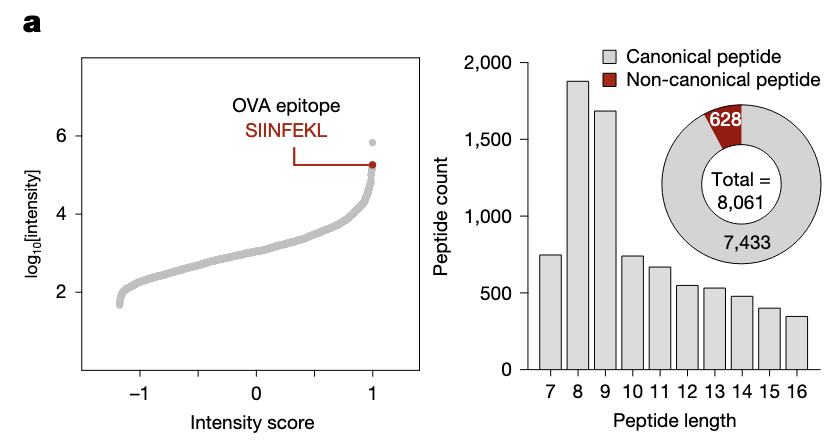
免疫肽组分析显示OVA肽与MHC-I结合。
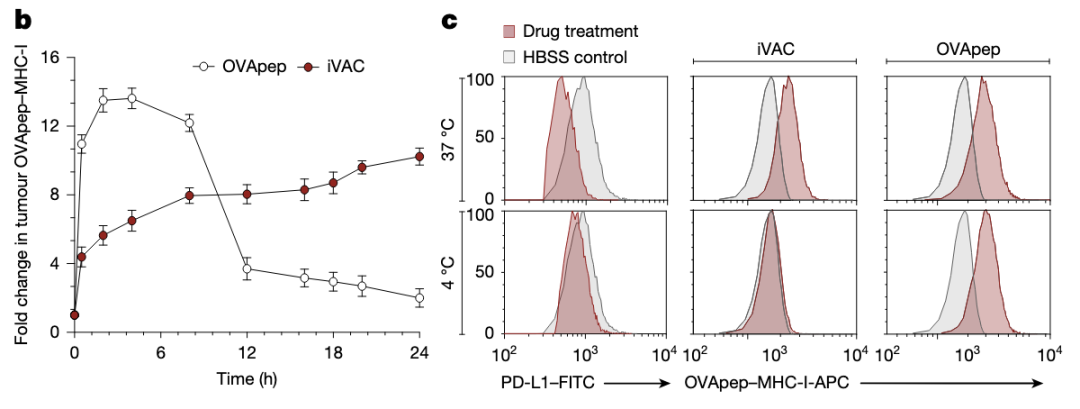
iVAC引起的OVA肽-MHC-I结合更持久,能被4 °C阻断。
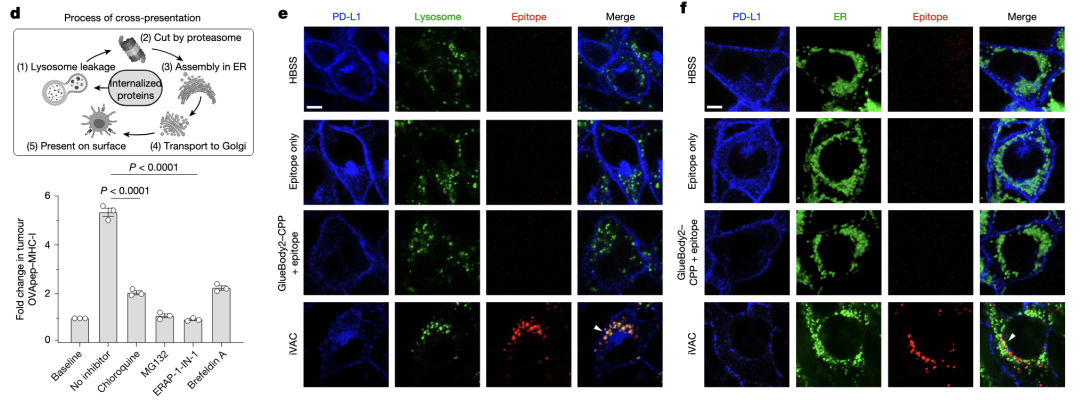
用抑制剂阻断抗原提呈的各个环节,均可抑制iVAC引起的OVA肽-MHC-I结合。
IF显示iVAC处理后抗原肽分布于溶酶体和内质网。
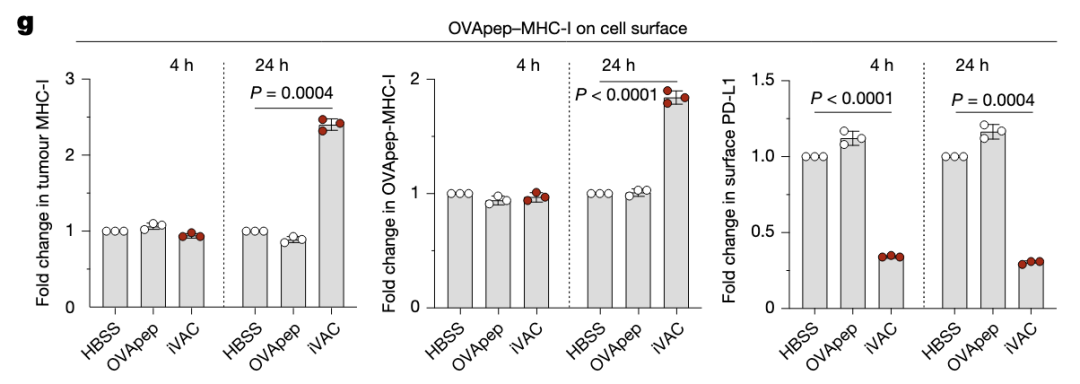
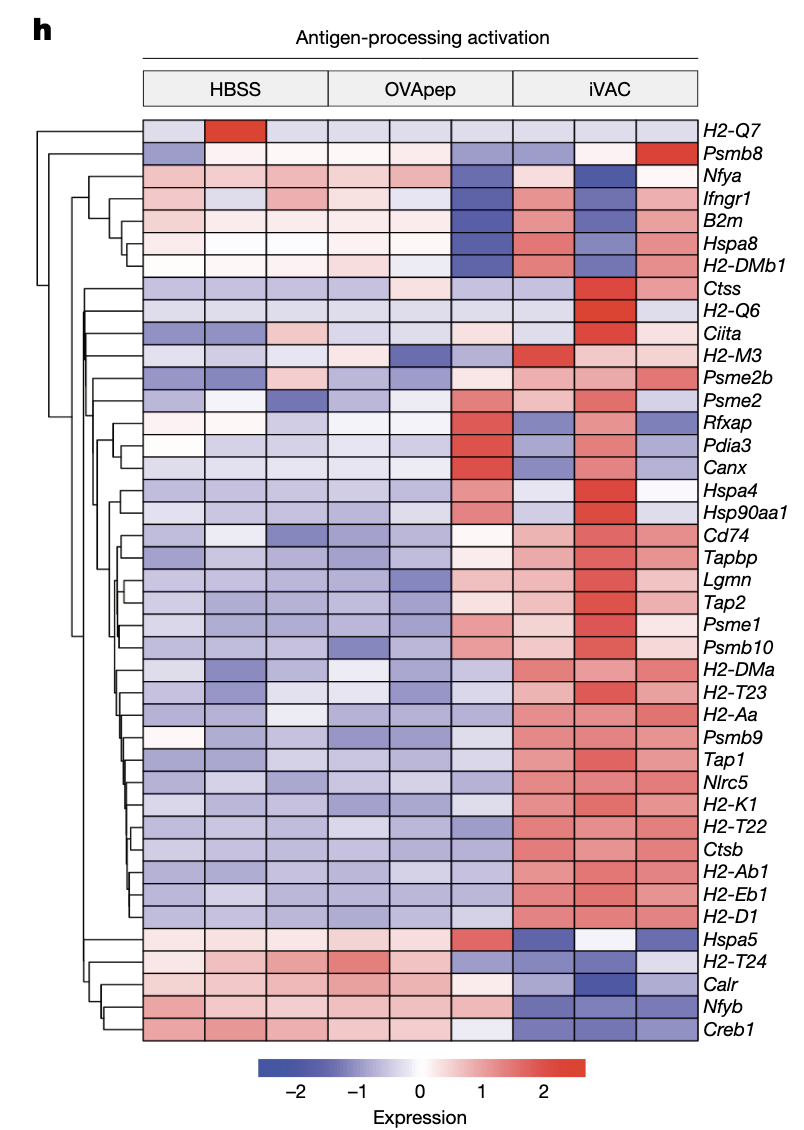
iVAC处理细胞后,细胞表面PD-L1下调,OVA肽提呈增加。
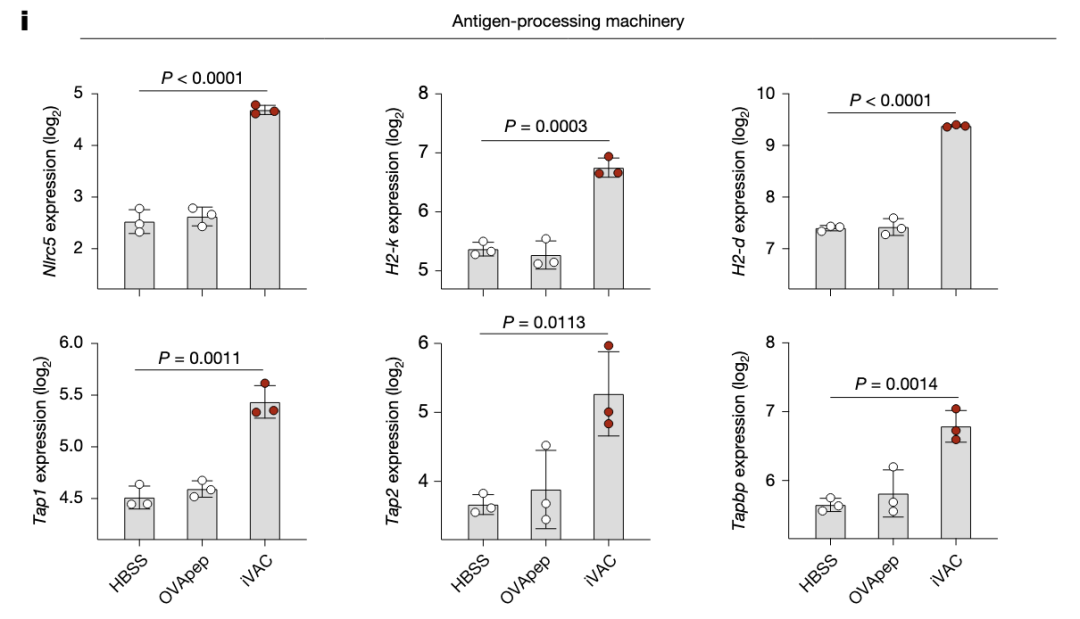
RNAseq显示iVAC组抗原提呈基因上调,肿瘤发生基因下调。

iVAC处理肿瘤细胞,降低PD-L1,上调MHC-I,促进T细胞增殖和激活。
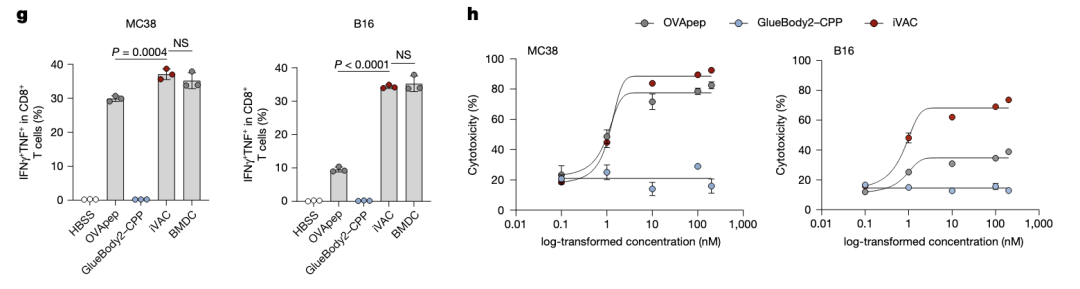
被激活的T细胞分泌更多的细胞因子,具有更强的肿瘤杀伤能力。
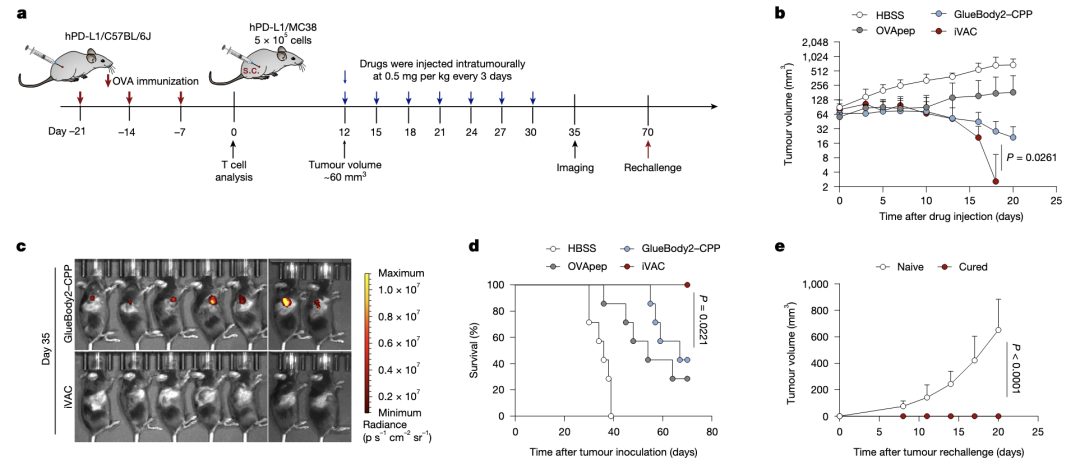
体内抗肿瘤实验。iVAC治疗疗效显著,且能诱发免疫记忆抵抗rechallenge。
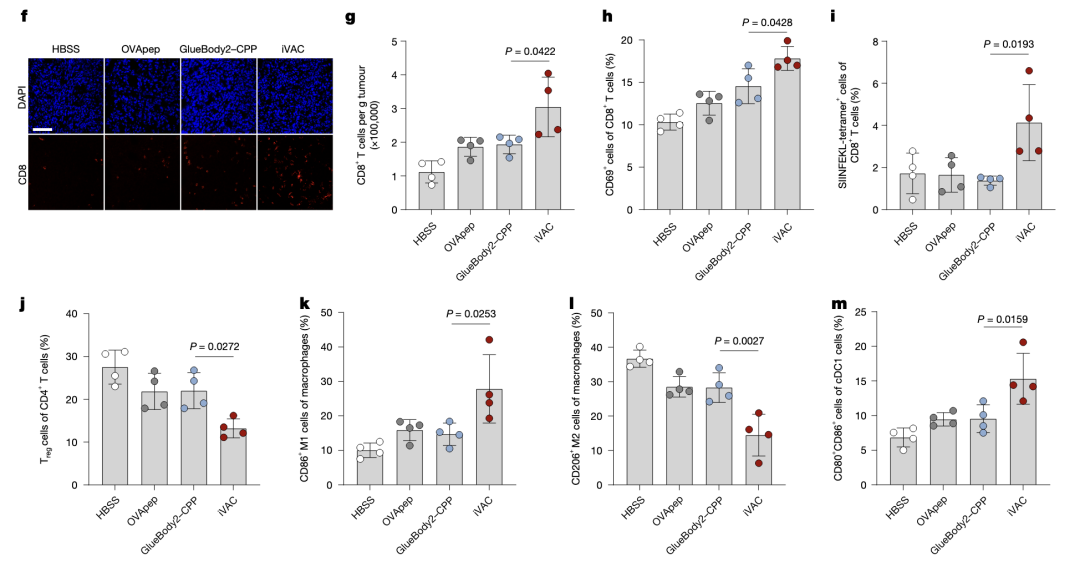
免疫微环境分析,TME中CD8 T细胞增多且被激活,Treg减少,M2向M1转变,cDC1的共刺激分子表达上调。
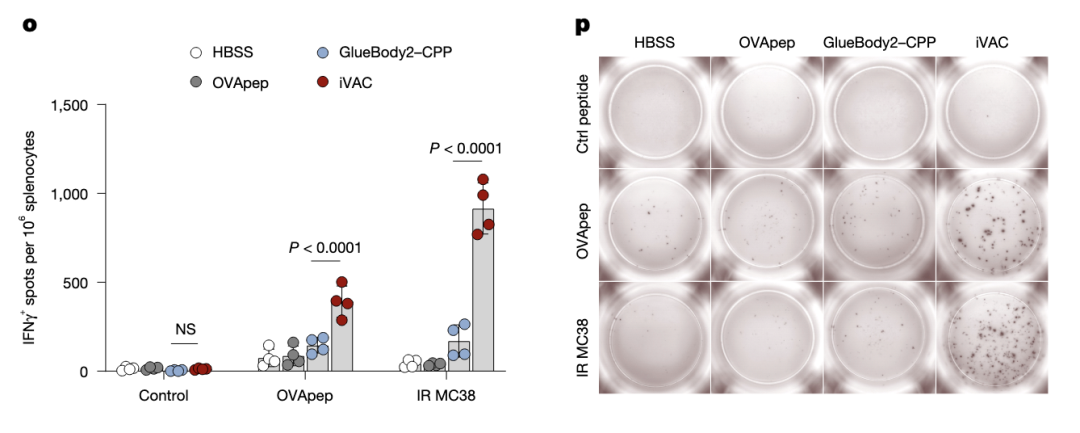
ELISPOT检测,iVAC治疗不仅引起针对OVA肽的免疫反应,同时也诱发出针对MC38肿瘤抗原的免疫反应,表明存在抗原播散效应。
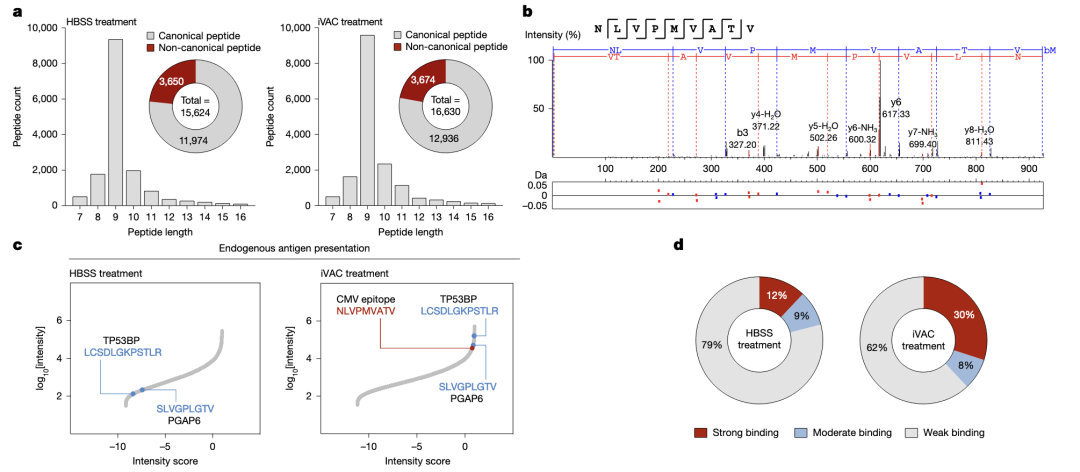
普适性扩展,在231细胞中进行尝试,将iVAC中的OVA肽换为CMV肽(由于CMV的高感染率和CMV特异性肿瘤记忆T细胞的大量存在。)
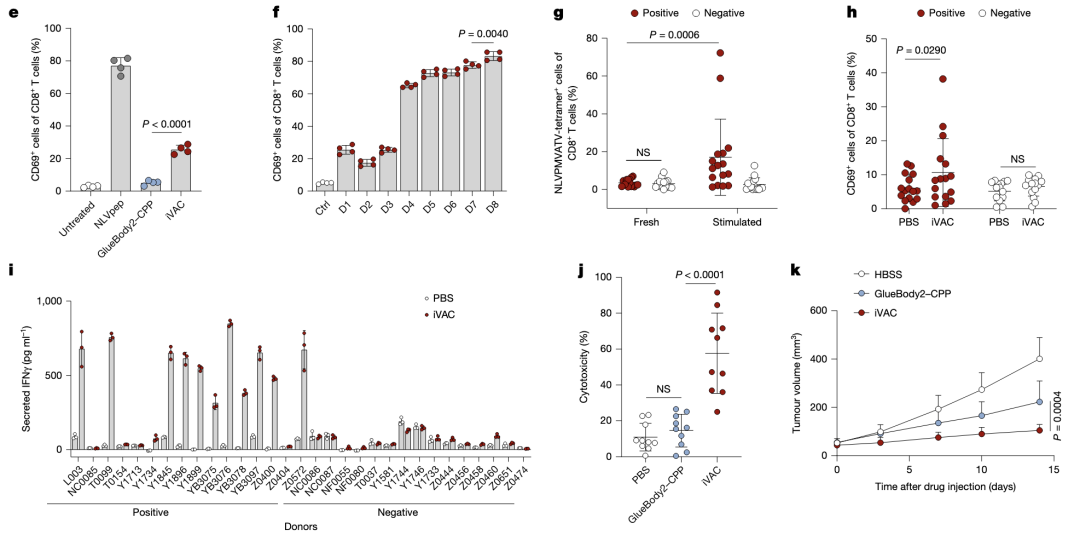
iVAC处理的细胞能够激活CD8 T,在CMV感染阳性的人群中这种激活显著。同时在免疫重建小鼠中验证了iVAC的抗肿瘤效果。
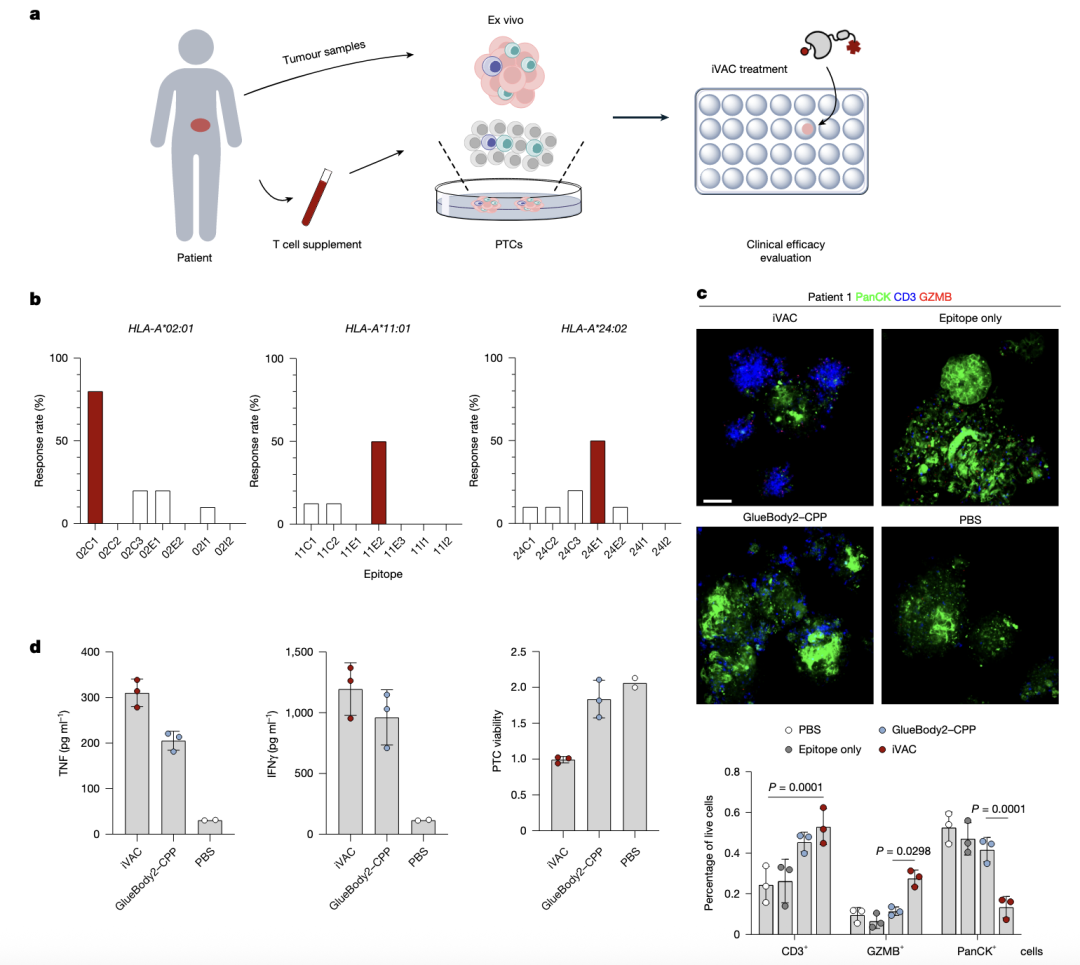
分离患者肿瘤中T细胞的病毒特异性如何,选择3个国人最常见的HLA类型(HLA-A*02:01, HLA-A*11:01和HLA-A*24:02),以及21个来源于CMV,EBV和流感病毒的肽表位来进行检测。
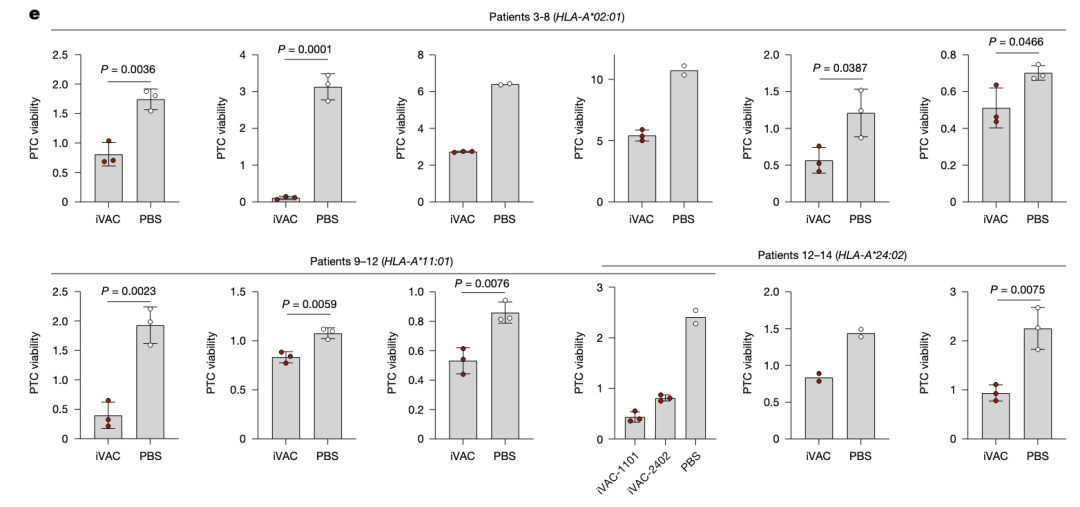
在不同患者来源的肿瘤中,iVAC都具有良好的肿瘤抑制效果。
?幻想时刻?
肿瘤疫苗作用的发挥需要依赖肿瘤抗原特异性T细胞,但肿瘤抗原异质性显著,且常有下调出现,策略逐渐转变为利用体内已经存在的抗病毒特异性T细胞。最近有多篇文章报道过这种策略,利用人体感染过的常见的病毒(Mol Ther | 利用针对病毒的特异性T细胞增强肿瘤免疫治疗效果),或接种过病毒疫苗(Nat Biomed Eng | 利用抗病毒免疫实现抗肿瘤治疗:肿瘤疫苗联合溶瘤病毒的一个新思路),体内存在相应的记忆性T细胞,然后人为通过某种方式让肿瘤表达病毒抗原,体内激活记忆性T细胞去攻击肿瘤。
“君子性非异也,善假于物也”。善于利用已经存在的事物可以起到意想不到的效果,事物的存在有好有坏,但皆有意义,就像病毒的感染让人恐惧,但关键时刻却是抗肿瘤的凭借。
靶向蛋白降解偶联外源抗原加工提呈,这个思路确实巧妙,充分体现了融合蛋白的魅力和潜力,可以预想到在未来,这个领域具有更为广阔的想象空间。
偶联,也许不单单是两个个体通过媒介连在一起。空间的协调,时间的延续,功能的适配,独立的统一,将会创造出一套新的操作系统,上演一出未曾登台的好戏。




