文章来源公众号:医药学术 作者:医药学术编辑部
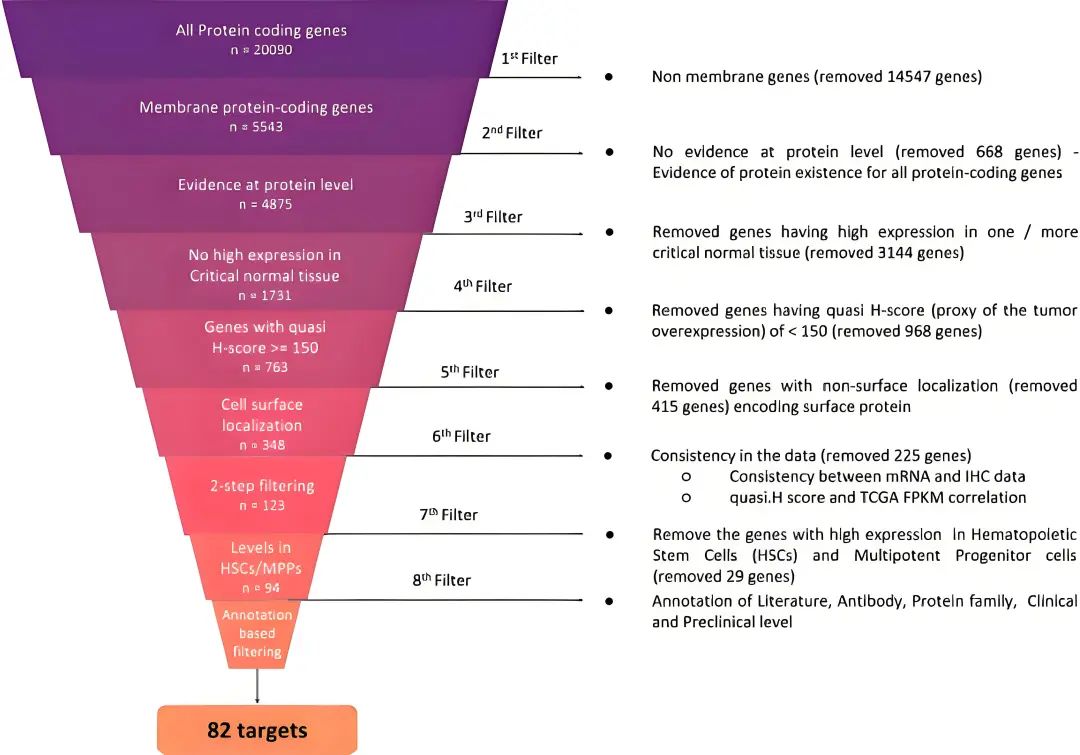
【TROP-2】

▼ 靶向TROP2靶点ADC结构
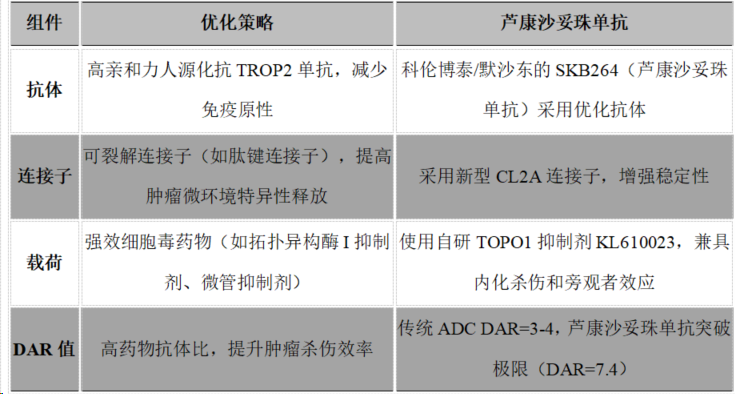
其他靶向TROP的ADCs结构见图2。
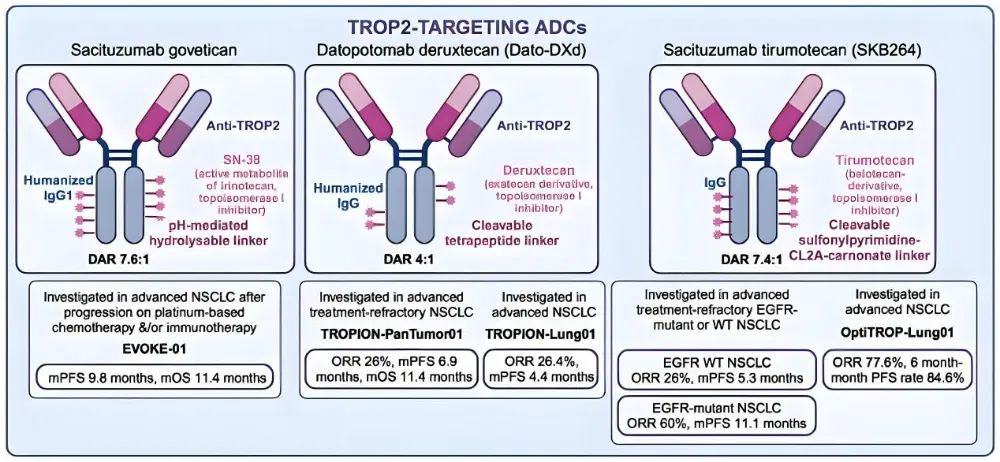
▼ 核心挑战与应对策略

▼ 载荷依赖性耐药
【FOLR1】
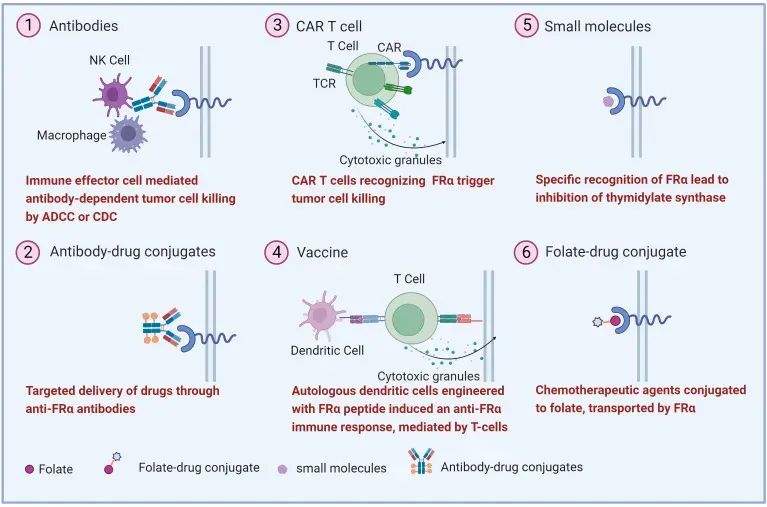
▼ FOLR1 ADC的科学设计逻辑
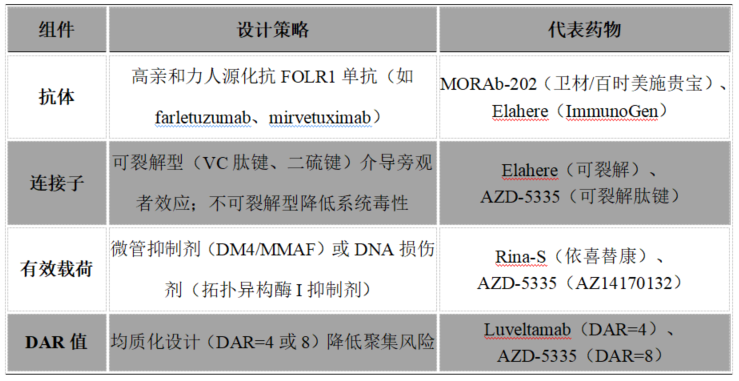
▼ 作用机制
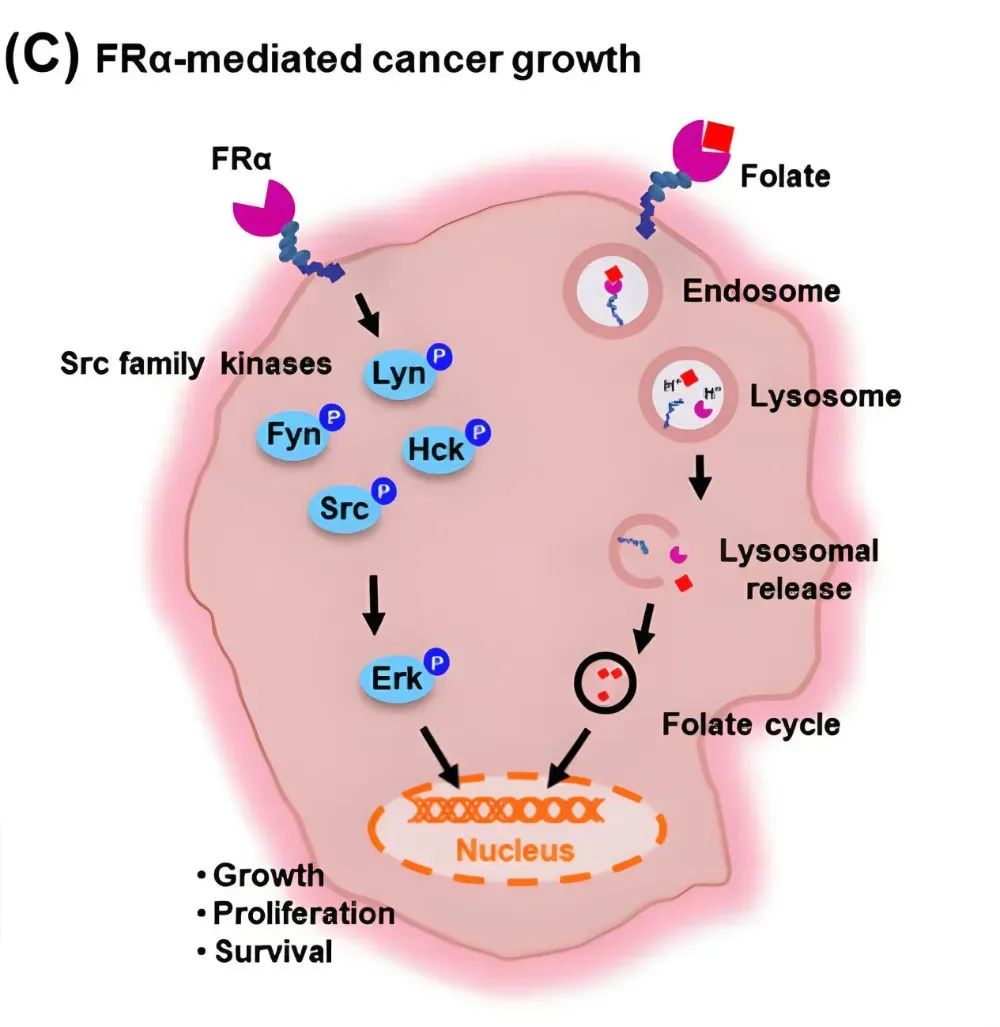
▼ 耐药性挑战
【总结】

文章来源公众号:医药学术 作者:医药学术编辑部

【TROP-2】

▼ 靶向TROP2靶点ADC结构

其他靶向TROP的ADCs结构见图2。

▼ 核心挑战与应对策略

▼ 载荷依赖性耐药
【FOLR1】

▼ FOLR1 ADC的科学设计逻辑

▼ 作用机制

▼ 耐药性挑战
【总结】

