文章来源公众号:生物药观察 作者:生物药观察
ADC在肿瘤领域的应用已经被充分验证,目前18款ADC获批上市,包括7款血液瘤产品,11款实体瘤产品。随着工程技术的成熟,ADC不断被拓展到其他领域。ADC在自免的应用首当其冲。(1)免疫抑制剂的系统毒性问题:小分子免疫抑制剂具有全身的免疫抑制,因此在强大药效的同时不可避免带来系统毒性。如糖皮质激素长期给药后的股骨头坏死、骨质疏松、高血糖等。因此临床上的共识就是尽可能避免激素使用,或尽量控制口服激素剂量。自免ADC在理论上可以靶向特定的免疫细胞或炎症局部,实现免疫抑制剂的靶向递送,减少免疫抑制剂的系统暴露。(2)小分子抑制剂成药问题:针对小分子药物存在成药性问题,如PK问题,可以通过ADC设计改善代谢特征,同时可以降低给药剂量和频率,提高患者依从性。自免ADC探索的先驱当属Abbive,为了应对前药王修美乐的专利悬崖,Abbive先后开发了ABBV-3373和ABBV-154两款TNFa-GRM ADC。
(1)ABBV-3373
ABBV-3373是由阿达木单抗与糖皮质激素受体调节剂(GRM)组成的ADC,Linker为MP-Ala-Ala,DAR值为4。偶联上使用水解开环的马来酰亚胺作为偶联基团,避免血浆循环中因逆迈克尔反应导致的激素提前释放。
在GRM设计上,艾伯维做了一系列的筛选,确定的激素分子结构如下,激素半衰期约为3-4h左右(CD1小鼠)和1-3h(SD大鼠)[1]。体外研究表明,ABBV-3373可以通过受体介导的内吞实现内化,并在溶酶体释放激素分子,抑制免疫细胞(moDC和PBMC)中促炎因子的释放。在高浓度下(>25ug/ml)有一定的非TNF依赖的内吞作用。在接触超敏反应(CHS)模型中,根据皮质酮水平评估,ABBV-3373在对下丘脑-垂体-肾上腺(HPA)轴影响最小的剂量下有效抑制了耳朵肿胀。这与口服泼尼松治疗观察到的非选择性抑制形成对比。在胶原诱导的关节炎(CIA)模型中,在疾病发作时给予单剂量的ABBV-3373可迅速减轻爪肿胀,保持缓解30天以上,并减轻关节病理,包括血管翳(pannus)形成、骨侵蚀和软骨损伤。这种疗效超过了单独的抗TNF抗体治疗,没有诱导与全身糖皮质激素暴露相关的体重减轻。即使在关节炎疾病的高峰期(抗TNF抗体显示出最低疗效的时间点)给药,3373也能减轻爪肿胀并延缓骨丢失的进展。与单独的抗TNF抗体治疗相比,ADC对炎症细胞因子如IFN-γ、IL-6、TNF和IL-17A表现出更广泛的抑制作用。在FIH研究中[3],ABBV-3373 ADA发生率高达69%,这可能和阿达木单抗的免疫原性有关,且SC给药的ADA要显著高于IV给药。激素的暴露量Cmax小于1ng/ml,且SC给药的激素暴露要高于IV给药(皮下给药可能引起蛋白酶分泌导致激素提前释放)。激素的体内半衰期为3.6天(100mg SC),增加剂量时半衰期可达10天。安全性方面,ABBV-3373 耐受性良好,不良事件多为轻度。仅在最高剂量(900 mg IV)组观察到一过性的皮质醇水平下降(全身糖皮质激素活性的PD指标)。
单细胞转录组学分析显示,ABBV-3373治疗后,表达TNF的单核细胞群体中GC调节基因CD83的表达减少,证明细胞内有效载荷递送至靶细胞的。在RA的II期临床研究中,ABBV-3373和阿达木开展了头对头的临床研究[4]。在第 12 周,ABBV-3373 组的 DAS28-CRP 评分从基线平均降低了 2.65 分。这一结果在统计学上显著优于预设的阿达木单抗历史数据阈值(-2.13),P=0.022。但和试验组(in trail ADA)相比优势不明显。此外,ABBV-3373 组有 17 名患者达到了低疾病活动度(DAS28-CRP ≤ 3.2),这 17 名患者12 周治疗停药后,在第 24 周时仍有 70.6% (12/17) 的患者维持着低疾病活动度,提示ABBV-3373可能实现深度缓解。
安全性方面,ABBV-3373共报告 4 例 SAE:1 例肺炎、1 例上呼吸道疾病、1 例非心源性胸痛和 1 例过敏性休克。基于对血清皮质醇水平的监测,在 12 周治疗期间未观察到全身性糖皮质激素效应。
(2)ABBV-154
为了提高成药性,艾伯维对ABBV-3373的连接方式、Linker及Payload进行改造并开发了新一代分子ABBV-154。
ABBV-154采用了溴乙酰胺-半胱氨酸偶联方式增强了ADC的血液稳定性、Gly-Glu Linker替换Ala-Ala增加了亲水性、Payload在原来基础上增加了一个磷酸基团PO4从而进一步增加亲水性和成药性[5]。

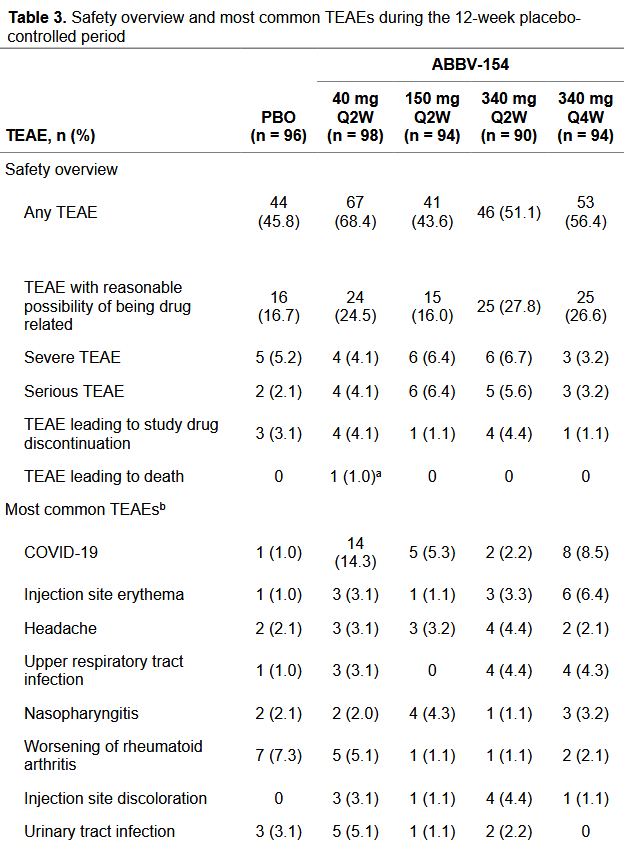
ABBV-154在RA的II期临床研究(AIM-RA,NCT04525823)数据于2025年6月发表[6]。这项研究旨在评估其在对甲氨蝶呤(MTX)及至少一种生物或靶向合成DMARDs(b/tsDMARDs)应答不足的中重度活动性类风湿关节炎患者中的疗效与安全性。所有治疗均为皮下注射(SC),并联用稳定的背景 MTX 治疗,给药剂量为40mg Q2W, 150mg Q2W, 340mg Q2W, 340mg Q4W, or placebo Q2W。
尽管试验提前终止,但在12周评估节点已获得了关键的疗效数据,显示出明确的治疗获益。所有 ABBV-154 剂量组在第12周的 ACR50 应答率均显著高于安慰剂组(P<0.001),证明了其临床疗效,且观察到剂量-效应关系,疗效随剂量增加而提升。ACR70 应答率在多数剂量组也显著优于安慰剂(P<0.05),提示 ABBV-154 一定程度上有潜力诱导深度临床缓解。
GRM血清暴露量不高:不同剂量下W12 谷浓度分别为 0.03、0.07、0.14ng/kg。安全性方面,截至第12周,所有 ABBV-154 治疗组的总体 TEAE 发生率与安慰剂组相当。常见的非严重不良事件包括注射部位反应、上呼吸道感染等,与安慰剂组无显著差异。ABBV-154 治疗组共报告了 10 例严重感染,主要包括肺炎和 COVID-19,因不良事件导致的停药率随剂量升高略有增加,但总体低于10%。尽管 ABBV-154 设计旨在将糖皮质激素效应局限在炎症组织,但结果表明其仍可能导致一定的全身性免疫抑制,增加了机会性感染和严重感染的风险。
ABBV-154在风湿性多肌痛的II期临床研究(AIM-PMR)数据于2025年2月发表[7]。AIM-PMR 是一项旨在评估 ABBV-154 作为糖皮质激素减量辅助疗法在 PMR 患者中有效性与安全性的关键 II 期研究,共 181 例患者按约 1:1:1:1 的比例随机分配至四个治疗组。ABBV-154 或安慰剂每两周一次(Q2W)皮下注射,同时所有患者均遵循一套标准化的糖皮质激素(泼尼松或等效剂量)逐步减量方案,主要终点为疾病复发的时间(Time to Flare)ABBV-154 在所有关键疗效终点上均显示出统计学显著且具有临床意义的改善,并呈现清晰的剂量-效应关系。在药效方面,试验组的疾病复发时间显著长于安慰剂组。在24周,不同给药浓度下,GRM激素的谷浓度分别为0.028, 0.065, and 0.177 ng/mL 。不良事件(TEAE):所有 ABBV-154 组的总体 TEAE 发生率与安慰剂组相当。最常见的不良事件包括 COVID-19(16%)、鼻咽炎和关节痛,发生率在各组间无显著差异。研究中报告了 2 例肿瘤事件(分布在不同剂量组),经评估被认为可能与研究药物相关。
PMR 领域的主要竞争来自 IL-6 抑制剂(如已获批的 Sarilumab)和在研的 JAK 抑制剂。这些药物同样能有效控制炎症并减少激素用量。ABBV-154 未能证明其相比这些机制具有更优的综合价值。
2023年艾伯维宣布终止ABBV-154的开发。主要理由是:“虽然ABBV-154显示出来一定的疗效,但也观察到了一些与较高剂量的系统性糖皮质激素暴露相一致的生物标志物的变化。利益-风险比不足以使ABBV-154与其它可用的治疗方法区分开来。”总结:
TNFa-GRM的失败可能的原因
1 靶点问题:体内大量游离的TNFα可能导致激素的提前释放和系统毒性
2 抗体问题:阿达木单抗本身就有很高的ADA,做成ADC存在同样问题,抗药抗体会导致药物中和或降解,释放激素,提高毒性
3 药效问题:虽然看到一定的药效优势,但优势并不十分显著,其综合表现未能超越艾伯维自身的免疫管线产品(如 Rinvoq 和 Skyrizi)以及市场上的其他竞品,因此不具备继续投入进行 III 期开发的商业价值
4 其他:虽然皮下给药对自免患者具有显著的依从性优势,但是皮下给药也同时导致更多激素暴露,一定程度上增加了毒性



