随着越来越多的生物制品进入治疗领域,该类制品的质量控制也日趋严格,其中核酸残留一项是各类质控标准的重中之重,因为DNA的稳定性,容易在生产过程中产生残留,而这些生物制品应用到人类疾病治疗时,会带来不可控危险因素。终产品的宿主核酸残留量必须遵循WHO、FDA和EMEA以及我国NMPA监管条例。尤其近年来包括大牌进口产品在内的狂犬疫苗DNA残留超标问题,引起了社会和业界的广泛关注。
生产生物制品的宿主细胞多是连续传代细胞(continuouscelllines, CCLs),其调控生长的基因失灵,而拥有无限增殖的能力,CCLs的残留DNA可能使人体细胞生长失控,变成肿瘤细胞。所以需要严格控制生物制品的残余DNA,避免这种风险危害。1984年的国际会议上采纳了残余DNA的临时标准,即来自CCLs的生物制品DNA残留不能超过10pg/人份剂量。1986年WHO的会议指出残余宿主DNA的主要风险与其潜在致瘤活性有关。
此外,残余DNA中可能存在感染性病毒基因组,病毒基因组能够扩增并产生感染性病毒粒子。体外实验表明,1pg逆转录病毒的前病毒DNA就具有感染性。有些残留DNA可能携带HIV病毒或者Ras致癌基因,DNA感染性风险可能比致瘤风险更高。
另外,有学者认为,接种几十针疫苗后,其残余的DNA累积可能具有其他潜在危害:未发生降解的外源DNA,在哺乳细胞基因LINE-1的逆转录转座子作用下有插入细胞基因组的可能性,带来其他潜在风险。
而且,由于微生物来源的基因组DNA富含CpG和非甲基化序列,增加了重组蛋白药物在体内的免疫原性风险,可能增加体内免疫反应,诱导产生DNA抗体。
因此从安全角度,在生物制品的生产工艺中必须有去除DNA的步骤,并进行检验验证。有研究采用病毒DNA定量感染的方法评价DNA的灭活程度,采用逐典全能核酸酶可消除其感染活性。WHO和各国药物监管机构一般控制100pg/每剂量的残留DNA,特殊情况下最高允许10ng/剂量。
我国部分疫苗及治疗用生物制品残留DNA标准
(中国药典2015)
| 来源 | 名称 | 细胞 | DNA残留标准 |
| 进口疫苗 | 小儿麻痹疫苗 | Vero | 10pg 剂量-1 |
| 狂犬病疫苗 | Vero | 10ng odose-1 | |
| 国产疫苗 | 肾综合征出血热疫苗 | Vero | 100pg 剂量-1 |
| 乙型脑炎疫苗 | Vero | 10pg 剂量-1 | |
| 狂犬病疫苗 | Vero | 100pg 剂量-1 | |
| 乙型肝炎疫苗 | Vero | 10pg 剂量-1 | |
| 甲型肝炎灭活疫苗 | Vero | 100pg 剂量-1 | |
| 治疗性生物制品 | EPO、单克隆抗体等 | CHO | 100pg 剂量-1 |
| 干扰素、GM-CSF、白介素等 | E.coli/Yeast | 10pg 剂量-1 |
我国参照WHO、FDA和欧盟标准,很早就对生物制品中残余DNA含量进行限制。从卫生部颁布的《人用重组DNA制品质量控制要点》到近年的《中国生物制品规程》和药典,都对DNA残留做了严格要求,部分标准高于国际标准。美国药典2015版(USP38-NF33)中增加了新的章节(General Chapter<30>)来进一步规范残留DNA的检测方法和标准物质。新版USP中将唯一推荐qPCR法作为生物制品中的宿主残留DNA检测方法。
此外,在CAR-T细胞治疗中,病毒包装后的核酸去除也是必要质量控制,必须保证回输的细胞足够纯,减低风险和危害。
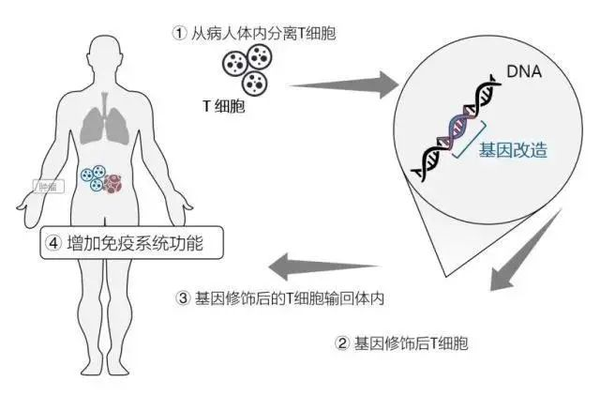
除却生物制品中必须要去除核酸残留,在平常的蛋白提取、生化分析样品回收中,核酸残留的影响也是非常大的,有效去除核酸残留,可明显降低细胞裂解液粘度,提高蛋白得率,蛋白生化分析中也可提高分辨率,并提高回收率。
在核酸残留去除工作中,难点是由于DNA带有大量的电荷易与其他生物大分子结合从而产生聚集(吸附)、包裹作用而难以完全除去。传统的方法均存在低含量核酸残留去除不净、工作量大耗时长的致命缺陷,全能核酸酶可完美解决此类难点。
常用核酸去除方法
| 方法 | 作用 | 特点 |
| 离子交换层析 | DNA带有大量的负电荷,可以被阴离子交换剂吸附而除去 | 负载量大、成本低廉,其缺点是在DNA残留要求较高的情况下难以达到。 |
| 鱼精蛋白沉淀 | 鱼精蛋白为碱性蛋白,带有大量的正电荷,能够与DNA结合生产沉淀,从而将DNA去除 | 操作简便、迅速,能有效降低DNA 残留量。 其缺点在DNA残留要求较高的情况下难以达到;需要使用大量的鱼精蛋白,容易造成鱼精蛋白残留。 |
| DNaseI | DNase Ⅰ具有DNA酶活性而不具有RNA酶活性,主要用于RNA去除DNA | 用于重组蛋白等去除DNA活性偏低,效果不理想 |
| 全能核酸酶 | 能够降解各种形式DNA和RNA,对单链、双链、线状、环状和超螺旋形式的DNA和RNA的磷酸二酯键均具有很高的活性,产生5’-磷酸核苷酸或5’-磷酸寡核苷酸 | 高效去除核酸残留,且对核酸没有序列要求操作简便耗时短 |
逐典Pannarase全能核酸酶是一种来源于Serratia marcescens的非特异性核酸内切酶,该酶可以将任何形式的 DNA 和 RNA (线性、环形、超螺旋)降解成3-5bp的寡核苷酸,并可在一系列宽泛的操作条件下保持高效性。逐典全能核酸酶从E.coli中表达纯化并在GMP条件下生产,可高效去除各种样品中的核酸杂质,助力解决广大疫苗生产、基因和细胞治疗厂商解决产品的核酸残留问题;此外某些病毒生产中可能会涉及到高盐的环境,逐典Pannarase耐高盐全能核酸酶将成为您“疑难杂症”的最佳选择!
全能核酸酶优势:
1.无动物源性、无氨苄青霉素
2.杰出单位比酶活、更高效的核酸降解能力
3.先进的生产工艺,非传统His标签纯化、排除引入金属离子风险
4.严格的质控标准,内毒水平低,确保单位酶活的准确性以及批次间稳定性
全能核酸酶应用条件:
全能核酸酶的酶活会受到多种因素的影响(例如温度、pH、离子强度等),故用量范围也会从0.1 U/mL-250 U/mL不等。因此,不同的操作环境下酶的最佳浓度不同,需要通过实验设置梯度进行最佳条件的摸索。
应用实例:
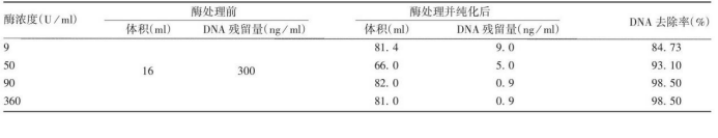
1.样品:狂犬病毒浓缩液
处理条件:核酸酶浓度50~90U/ml ,
37 ℃处理 2 h,转入18 ~ 26 ℃处理 6h
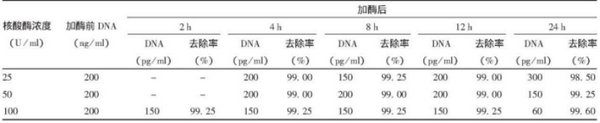
2.样品:狂犬病病毒浓缩液
处理条件:25、50和100 U/ml,37℃
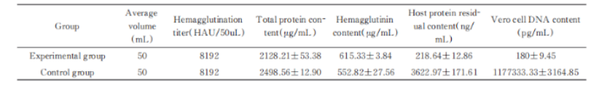
3.样品:流感病毒浓缩液
处理条件:10 U/mL,37℃
参考文献
[1] 崔燕平. 非限制性核酸内切酶对狂犬病疫苗中Vero细胞DNA的去除作用[J]. 中国生物制品学杂志, v.27(04):444-447.
[2] 刘杰,刘辉,杨会强,康庄,孙艳,毛川成,何敏,李玉华.多种方法结合去除冻干人用狂犬病疫苗中Vero细胞残留DNA[J].中国生物制品学杂志,2013,26(12):1827-1830.
[3] 阮朝列,施锦丽,李卫东等.Benzonase核酸酶在Vero细胞流感病毒灭活疫苗中的应用研究[J].病毒学报,2023,39(04):980-990.




