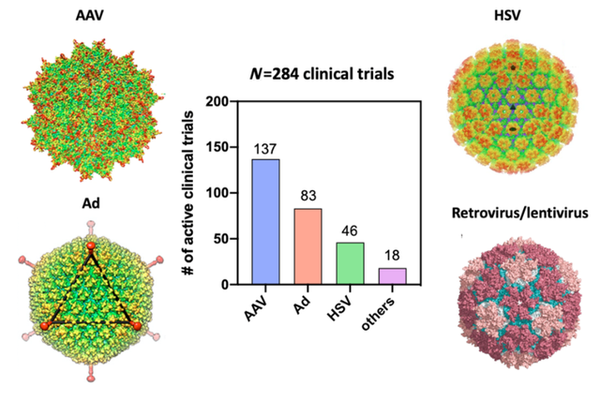
基因疗法目前是临床前和临床环境中研究最多的治疗方式之一,并在治疗各种疾病方面显示出前景。基因疗法的目标是将一种基因材料引入靶细胞,理论上可以治愈那些被认为是传统方法无法治愈的疾病。在许多情况下,基因治疗需要载体将基因治疗药物输送到靶细胞。病毒载体因其突出的转导效率等显著优势而成为研究最广泛的载体之一。经过几十年的发展,基于病毒载体的基因治疗已经取得了良好的临床效果。目前已有十几种病毒基因治疗产品被批准用于治疗癌症、传染病和单基因疾病。临床上用于体内基因治疗的主要病毒载体类型包括Ad、AAV、HSV、逆转录病毒和慢病毒(图1)。这里将简要介绍这些载体特征以及临床应用。
腺病毒(Ad)
腺病毒(Ad)是临床上最早用于体内基因治疗的病毒载体之一。Ad是一类DNA病毒,其基因组大小为34-43kb,包裹在一个无包膜的二十面体病毒颗粒中(图2)。有50多种Ad血清型,其中Ad5和Ad26是用于基因治疗最广泛的类型。
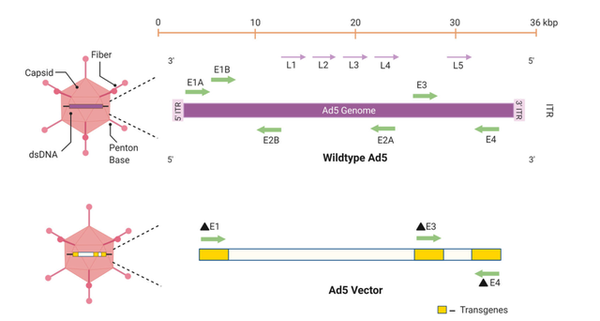
已设计了三代Ad载体以适应不同的治疗应用。第一代包括去除E1和E3单位,使载体能够携带高达7.5kb的外源DNA。第二代Ad载体中删除了E1和E4单元,大大降低了免疫原性。在允许载体携带超过30kb外源DNA的第三代中,所有病毒基因都被删除。
Ad载体的显著特征包括:
(1)多个基因组拷贝可以递送到一个宿主细胞,从而导致基因高表达水平;
(2)Ad载体的基因表达是暂时的,因为DNA货物是异体的,没有整合到宿主基因组中;
(3) 它们可以转导分裂细胞和非分裂细胞;
(4)它们具有高度的免疫原性。由于这些特点,以Ad载体为基础的基因治疗主要用于癌症治疗和传染病疫苗接种。
Gendicine®是世界上第一个获得批准的癌症病毒基因疗法,2003年在中国被批准用于治疗头颈部鳞状细胞癌。Gendicine®是基于人类Ad5基因,其中E1基因被编码人类野生型p53的基因取代,后者是一种肿瘤抑制基因。Gendicine®的作用机制依赖于肿瘤细胞中p53蛋白的表达,p53蛋白启动了凋亡途径,抑制了抗凋亡事件,并阻断了生存途径。Gendicine®已被临床研究用于治疗各种癌症,如膀胱癌、卵巢癌、肺癌、乳腺癌、肝癌等。
Oncorine®是另一种基于Ad5的癌症病毒基因疗法,于2005年在中国获得批准,用于在化疗的同时治疗晚期难治性鼻咽癌。Oncorine®是一种溶瘤病毒基因疗法,基于改进的Ad5,其中病毒基因E1B-55KD被完全删除,病毒中没有外源基因。E1B-55KD的缺陷允许病毒在p53缺失的肿瘤细胞中选择性复制,但不能在正常细胞中复制。病毒在受感染的肿瘤细胞裂解并释放出来感染邻近细胞。Oncorine®目前正在进行积极的临床试验,用于治疗其他癌症类型,包括难治性恶性腹水和肝细胞癌。
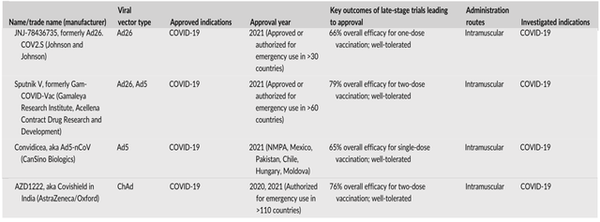
四种病毒基因治疗产品已被批准用于预防SARS-CoV-2感染的疫苗接种。这四种疫苗都是基于含有编码Spike蛋白基因的重组Ad载体(图3)。使用Ad的基本原理可能来自于Ad载体快速但瞬时的基因表达特性。快速基因表达能够快速诱导免疫反应,而瞬时表达的性质降低了安全风险。JNJ-78436735是目前唯一在美国获得紧急使用授权的新冠肺炎病毒疫苗。与其他已批准的新冠肺炎疫苗不同,JNJ-78436735被证明只需一剂就能安全有效,而不是两剂。AZD1222是一种基于黑猩猩Ad的新冠肺炎疫苗,是世界上第一个被批准的新冠肺炎病毒疫苗,现在已经获得在30多个国家使用的授权。然而,由于血栓风险增加,它最近在几个国家被暂停。
腺相关病毒(AAV)
腺相关病毒(AAV)是目前应用最广泛的体内基因治疗病毒载体。AAV是一种非致病性的细小病毒,DNA基因组长4.8kb,包裹在一个无包膜的二十面体衣壳内(图4)。AAV有11个自然血清型和100多个变种。不同的血清型对不同的组织具有趋向性,使每种血清型都适合将基因输送到特定的组织。例如,AAV9对中枢神经系统(CNS)器官具有趋向性,而AAV8可以有效地转导胰腺。
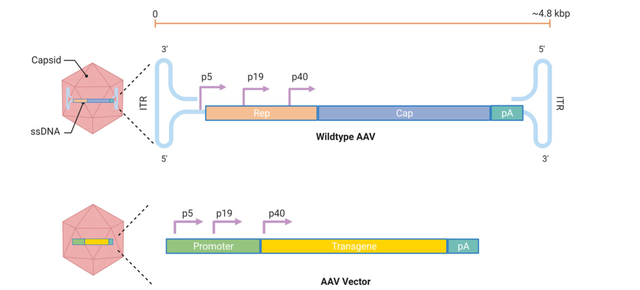
AAV载体的主要特点包括:
(1) 它们可以转导分裂细胞和非分裂细胞,并且不将DNA整合到宿主基因组中;
(2)它们能够长期稳定地表达基因;
(3)它们具有低的免疫原性。由于这些独特的特性,AAV是最适合体内基因治疗的病毒载体,特别是在需要长期基因修饰的情况下。它们的主要临床应用涵盖了广泛的单基因疾病的治疗,包括眼科疾病、代谢性疾病、血液疾病、神经疾病和肌肉骨骼疾病。
已有三种产品使用AAV作为病毒载体被批准用于治疗代谢性疾病、眼科疾病和神经疾病(图5)。主要归因于AAVs的独特特征,即它们缺乏致病性,表现出低的免疫原性,并且通常会导致长期的基因表达。尽管它们适用于不同的疾病,但它们的基本作用机制是相似的,即传递一个正确的基因来取代靶细胞中突变/功能失调的拷贝,以缓解甚至治疗疾病。
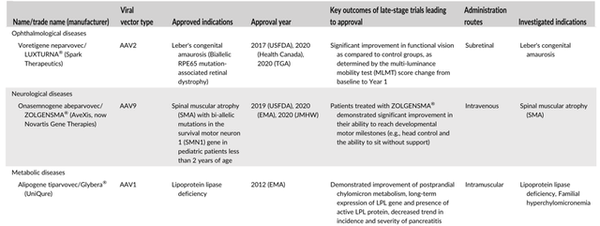
Glybera®是世界上第一个被批准用于治疗单基因疾病的病毒基因疗法。它于2012年被EMA批准用于治疗脂蛋白脂肪酶缺乏症,这是一种代谢遗传性疾病,患者的脂蛋白脂肪酶基因存在缺陷。Glybera®使用AAV1作为载体,在肌肉注射后将完整的人脂蛋白脂酶基因输送到肌肉细胞。Glybera®目前正在进行一项积极的临床试验,以研究其长期安全性和有效性。
作为美国FDA批准的首个单基因疾病基因疗法,LUXTURNA®于2017年在美国获得批准,随后于2020年在加拿大和澳大利亚获得批准,用于治疗双等位基因RPE65突变相关性视网膜营养不良。它基于包含人RPE65 cDNA的AAV2载体。LUXTURNA®目前正在http://Clinicaltrails.gov上进行五项活跃的临床试验,以研究其长期安全性/有效性或在特定人群中的治疗潜力。
ZOLGENSMA®是唯一被批准用于治疗神经疾病的病毒基因疗法。它于2019年被美国FDA批准用于治疗2岁以下儿童运动神经元存活1基因双等位基因突变的脊髓性肌萎缩症。与其他两种获批的单基因疾病产品不同,ZOLGENSMA®是静脉注射的。这在很大程度上依赖于工程AAV9载体对中枢神经系统器官的内在趋向性。ZOLGENSMA®目前正在进行多项临床试验,以研究其长期安全性和有效性,或通过其他给药途径探索其治疗潜力。
单纯疱疹病毒(HSV)
单纯疱疹病毒(HSV)是一种包膜病毒,具有超过150 kb的双链NDA基因组。该病毒基因组编码大约90个基因;其中一半基因是非必需的,可以在重组载体中移除/替换,从而提供高容量的外源DNA。已鉴定出8种人类HSV血清型,每种血清型都表现出不同的趋向性(图6)。
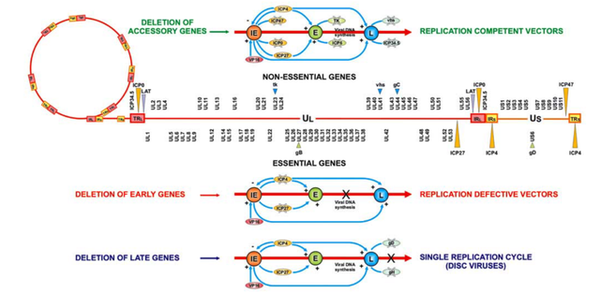
目前,已有三种主要类型的HSV载体用于基因治疗,包括扩增型HSV、复制缺陷型HSV和复制能力型HSV。复制缺陷的HSV载体通常是通过耗尽HSV裂解周期所需的基因而产生的,并且毒性和免疫原性较低。具有复制能力的HSV载体是一种工程HSV,它保留了用于体外复制的基因,但删除了用于在体内复制的基因。
HSV载体的主要特征包括:
(1)它们逃避免疫系统的能力;
(2)运送大DNA货物和多基因的能力;
(3)固有的或工程的细胞特异性裂解特性。基于HSV载体的基因治疗的临床应用主要集中在癌症治疗上,主要归因于其固有的溶瘤能力。
IMLYGIC®是FDA批准的第一种种针对癌症的病毒基因疗法。IMLYGIC®被批准用于治疗首次手术后局部复发的不可切除的皮肤、皮下和结节性黑色素瘤,通过直接瘤内给药。IMLYGIC®是基于一种改良的单纯疱疹病毒1型病毒,其中编码感染细胞蛋白ICP34.5和ICP47的两个病毒基因γ34.5 和α47被删除,取而代之的是人粒细胞-巨噬细胞集落刺激因子(GM-CSF)基因。γ34.5基因的缺失使病毒能够在肿瘤中选择性复制,但在正常组织中不能复制。α47基因的缺失消除了对病毒免疫反应的抑制,并有助于激活免疫系统。局部表达的GM-CSF可吸引树突状细胞的浸润以呈递肿瘤抗原,随后导致针对肿瘤的适应性免疫反应。除了黑色素瘤外,Imlyic®已被临床研究用于治疗其他实体肿瘤。
逆转录病毒(Retrovirus)
逆转录病毒是第一个在体内基因治疗的临床试验中被研究的病毒载体。逆转录病毒是一种有包膜的球形病毒,以RNA的形式携带其遗传物质。逆转录病毒载体可以将其遗传物质(单链RNA)反向转录成双链DNA,并整合到宿主细胞的基因组中。
用于基因治疗的逆转录病毒载体的主要优点是它们可以携带一个大的目的基因(9-12kb),并由于它们整合到宿主基因组中而导致基因的长期表达。然而,几个主要缺点限制了它们的应用。首先,逆转录病毒载体需要细胞分裂才能将其DNA整合到宿主基因组中,因此它们只能转导分裂中的细胞。此外,逆转录病毒载体有将其DNA随机插入宿主染色体并导致插入突变的风险。为了降低插入突变的风险,已开发出具有长末端重复序列启动子或增强子缺失的自失活载体。由于这些局限性,逆转录病毒载体目前不再经常用于临床研究。
Rexin-G®是一种基于逆转录病毒的癌症病毒基因疗法,携带细胞杀伤性细胞周期蛋白G1基因,于2007年在菲律宾获得批准用于治疗实体瘤。Rexin-G®是一种肿瘤靶向病毒基因疗法,其肿瘤靶向能力归因于病毒载体上展示的一种冷冻SIG结合肽,该肽可以选择性地与肿瘤中的异常信号(SIG)蛋白结合。Rexin-G®的作用机制主要是基于肿瘤细胞中细胞周期蛋白G1的表达,使细胞周期停滞在G1期,从而引发细胞死亡和凋亡。继Rexin-G®在菲律宾获得批准后,Rexin-G®已在美国进行了几项一期或二期试验,用于治疗各种癌症,包括胰腺癌、肉瘤、乳腺癌和骨肉瘤。FDA于2008年批准Rexin-G®为治疗骨肉瘤和软组织肉瘤的孤儿药物,并于2009年批准其为胰腺癌的快速通道药物。
慢病毒
慢病毒是另一种重要的基因治疗病毒载体。它的主要应用是体外基因治疗。然而,它目前也在临床上进行体内基因治疗的研究。慢病毒是逆转录病毒的一个亚型,以RNA的形式携带遗传物质。然而,与逆转录病毒不同,慢病毒可以将其基因组整合到不可分裂的细胞中并进行转导。第一代慢病毒载体最初来自(人类免疫缺陷病毒1)HIV-1,并已证明其能够有效地在体内转导中枢器官(图7)。新一代慢病毒载体来自非人类慢病毒,理论上更容易被接受,因为它们的亲本病毒对人类不具传染性。
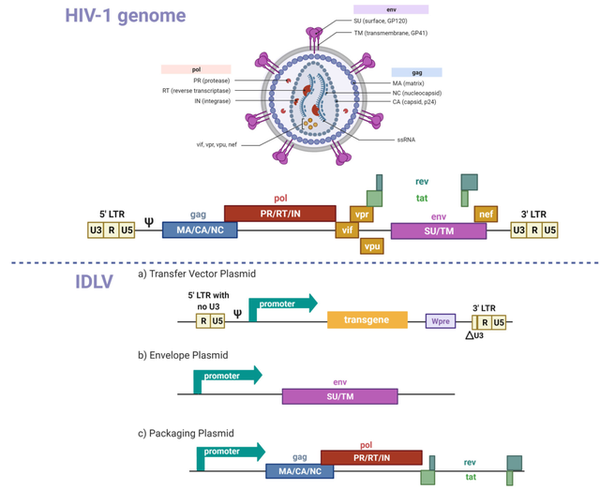
慢病毒载体的显著特征包括:
(1)转导分裂和未分裂细胞的能力;
(2)能够长期表达基因;
(3)与逆转录病毒载体相比,降低了遗传毒性和插入突变的风险。慢病毒载体的主要缺点是其有限的遗传运载能力。慢病毒载体用于体内基因治疗的主要应用是治疗单基因疾病和慢性疾病,包括神经系统疾病、眼科疾病和代谢性疾病。
除上述常见病毒载体外,其他病毒载体在临床上进行体内基因递送的研究也被报道。这些病毒包括水疱性口炎病毒(VSV)、改良痘苗病毒安卡拉(MVA)、仙台病毒、麻疹病毒等。例如,VSV因其固有的溶瘤能力而被研究用于治疗肝癌和晚期实体肿瘤。MVA由于其对抗原提呈细胞的趋向性而被广泛用于疫苗应用。
小编小结
基因治疗直接纠正/修饰基因,代表着一种革命性的疾病治疗方式。基因治疗在治疗谱中占有独特的地位,从某种意义上说,它是唯一可能治愈某些疾病(如遗传性疾病)的方法。许多基因治疗产品,特别是基于病毒载体的基因治疗,已在临床上获得批准,用于治疗一系列疾病,不仅包括遗传疾病,还包括癌症和传染病等其他适应症。最近对基于AAV的产品的批准使该领域发生了革命性的变化,并首次提供了一种治疗单基因疾病的方法。
除此之外,一些活跃的临床试验正在研究基于病毒载体的新的基因疗法以及新的基因修饰方法,例如,CRISPR介导的基因编辑,以及将基因治疗的范围扩大到新的适应症。然而,病毒基因疗法的进一步临床翻译面临着制造、生物和监管方面的挑战,需要临床前、临床和商业方面的巨大努力。但病毒载体工程、疾病基因组鉴定和基因编辑领域的科学进步正在将病毒基因治疗带入一个新纪元。
来源:生物制药小编




