文章来源公众号:终不似少年游 作者:闻李
这两天看了篇不错的综述,刚好结合一些近期ADC的进展,做个汇总学习。 
ADC是传统化药向精准靶向化药进化的关键里程碑。目前,全球共获批19个ADC(包括2个已退市),另有300多种ADC处于临床研发阶段。从获批时间线看,2019 年后 ADC 研发进入爆发期,技术迭代与临床突破显著加速。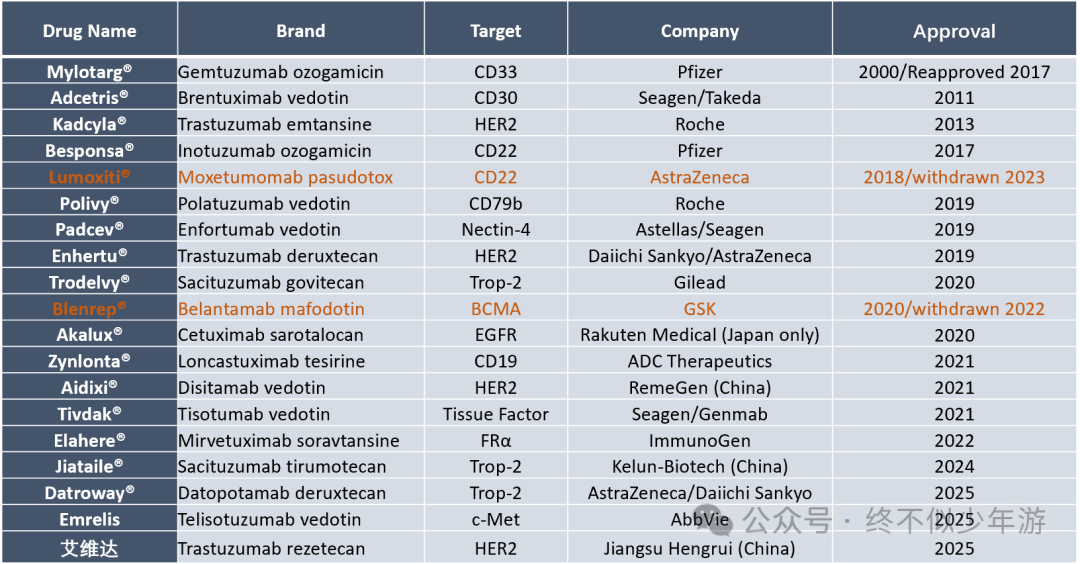
注:Blenrep(Belantamab mafodotin)正在寻求重新上市,包括2025 年 4 月获英国 MHRA 重新批准联合用药用于复发/难治性多发性骨髓瘤的二线治疗;7月获得欧盟批准联合治疗方案用于复发或难治性多发性骨髓瘤;而在美国则因为美国患者占比不足、临床对照方案与SOC不适以及严重的眼部毒性问题导致获批受阻,FDA延长审批至10月23日。 尽管ADCs已被广泛认可为具有变革意义的治疗手段,但其作用机制仍存在诸多亟待阐明的关键问题。越来越多的证据表明,ADCs的作用机制远比简化描述更为复杂。例如,传统对ADCs的解释往往低估了暴露动力学(exposure kinetics)的作用。正如某些化疗药物通过持续输注(continuous infusion )而非推注(bolus)给药时疗效更佳,ADCs载荷在循环系统中的持续释放能使药物浓度在数天内维持在体外细胞毒性阈值之上。这种延长的药物暴露期可能是ADCs发挥疗效的重要原因之一。 相反,传统模型却过度强调了ADCs对肿瘤的选择性摄取。放射性标记抗体研究显示,通常仅有不到1%的给药偶联物能到达肿瘤细胞,其余则分布于正常组织中。近期一项临床结局研究进一步凸显了这一特点:该研究发现,在接受T-DXd治疗的患者中,体脂率越高,治疗毒性越强且疗效越差。此外,尽管某些毒性与on-target, off-tumor的摄取有关,例如HER2相关的心脏毒性、TROP2相关的黏膜炎、Nectin-4和EGFR相关的皮肤毒性,以及TF相关的眼部毒性),但靶点相关不良事件极少会限制ADCs的耐受剂量。在大多数情况下,是载荷相关毒性决定了ADCs的最大耐受剂量,且其最大耐受剂量通常与该载荷对应的传统小分子类似物相当,相关毒性也相似,如疲劳、呕吐、脱发、血细胞减少和神经病变等。 越来越多的证据对“ADCs疗效严格依赖高抗原表达及内化过程”这一观点提出了挑战。靶点表达与ADCs疗效之间的关联存在显著差异。例如,即使在HER2阴性肿瘤患者中,T-DXd也显示出具有临床意义的疗效;而具有相同抗体骨架的T-DM1,仅对HER2高表达肿瘤患者有效——这很可能是因为其载荷不具备旁观者效应。Mirvetuximab soravtansine的临床试验发现,叶酸受体α(FRα)高表达是其在卵巢癌中发挥疗效的关键因素,因此该药物最终获批用于FRα高表达患者;而Telisotuzumab vedotin也仅获加速批准用于cMet高表达患者。相反,Tisotumab vedotin在宫颈癌中的临床试验显示,组织因子(TF)表达与疗效之间无相关性。其他靶点也存在类似情况:实体瘤中的B7-H3、HER3、Nectin-4、TROP2,以及血液系统恶性肿瘤中的BCMA、CD19、CD22、CD30、CD33、CD79b等,其表达水平与对应ADCs疗效均无明确关联。 另一个类似例子是最近大热的PD-L1 ADC HLX43,在PD-L1表达阴性的患者中,疗效同样显著,而辉瑞的SGN-PDL1V (PF-08046054)疗效只在PD-L1阳性患者中才有体现,虽然HLX43毒性也相应要大一些。这可能跟HLX43采用的是肿瘤TME胞外切割的三肽Linker有关。 新的临床前研究或许能解释上述差异背后的部分原因。Tsao等人证实,T-DXd在HER2阴性乳腺癌中的活性可独立于HER2结合过程而发生,这表明T-DXd在HER2低表达肿瘤中发挥疗效的机制,超出了直接靶向抗原的范畴。具体而言,肿瘤微环境中存在于肿瘤细胞及基质细胞中的组织蛋白酶L(cathepsin L),可裂解T-DXd的linker,实现细胞外载荷释放并发挥抗肿瘤活性——这一过程与HER2表达无关。这种非内化性载荷释放有别于传统的旁观者效应(传统旁观者效应中,药物需从癌细胞中循环至肿瘤微环境)。 组织蛋白酶L介导的细胞外载荷释放这一发现或许具有偶然性。T-DXd的GGFG linker最初设计为可被溶酶体组织蛋白酶在细胞内裂解。其他常见的蛋白酶可裂解linker(如缬氨酸-瓜氨酸、缬氨酸-丙氨酸),也是包括组织蛋白酶L在内的多种组织蛋白酶的底物,因此也可能发生类似的细胞外裂解。之前在《PYX-201:非内化ADC可以如此简单?》里提过,非内化ADC PYX-201选择了常规的VC linker。这些发现为以下研究提供了新的动力:1)探究现有linker对ADCs疗效的贡献,2)开发新型肿瘤选择性linker,以及3)评估组织蛋白酶表达作为患者筛选潜在标志物的可行性。 目前,优化现有生物标志物预测效能的研究也在积极开展中。标准免疫组化(IHC)依赖人工将样本划分为离散的几个类别(如HER2 0、1+、2+或3+),这种分类方式范围过宽、特异性不足且具有主观性。新方法将灵敏的分子检测与定量分析相结合,以确定具有预测意义的靶点表达阈值,包括mRNA检测、定量免疫荧光及反相蛋白阵列技术等。部分方法还纳入了通路激活指标(如磷酸化水平)或细胞内转运基因表达水平的检测。尽管多数研究聚焦于HER2,但FDA近期首次为一款TROP2检测平台授予了“突破性设备认定”,该平台属于计算病理学伴随诊断工具。当存在多种ADCs可供选择时,这些定量方法有望更好地筛选患者,并为治疗顺序决策提供依据(https://www.roche.com/media/releases/med-cor-2025-04-29)。 ADCs的抗体骨架是另一个日益受到关注的领域。传统模型聚焦于靶点特异性及内吞过程,却低估了抗体骨架的免疫效应功能,如抗体依赖性细胞吞噬作用(ADCP)和抗体依赖性细胞毒性作用(ADCC)。以往研究表明,T-DM1和T-DXd均保留了未偶联(裸)曲妥珠单抗已知的作用机制。携带其他载荷的ADCs在免疫功能正常小鼠中的疗效也优于裸鼠,这提示T细胞可能参与了ADCs的抗肿瘤活性。CD47信号通路的上调会减弱这种免疫相关活性,但联合使用CD47检查点抑制剂可恢复其活性。其他临床前研究发现,ADCs载荷诱导的免疫原性细胞死亡(ICD)可使肿瘤对检查点抑制剂更敏感。在临床应用中,Enfortumab vedotin(EV)联合帕博利珠单抗(pembrolizumab)已获批用于尿路上皮癌的一线治疗。近期Sacituzumab govitecan(SG)联合帕博利珠单抗(pembrolizumab)治疗TNBC、Disitamab vedotin 联合Toripalimab治疗胃癌的研究取得阳性结果,这为在不同肿瘤类型中探索类似联合方案提供了支持。 与此同时,某些ADCs毒性可能源于Fc介导的相互作用。例如,T-DM1相关的血小板减少症与FcγRIIa依赖性、HER2非依赖性的血小板生成受损有关。而T-DXd相关的间质性肺病(ILD),也被推测与Fc受体和肺泡巨噬细胞的相互作用有关。 尽管所有已获批的ADCs及大多数处于临床研发阶段的ADCs均保留有功能完整的Fc段,且仅有少数ADCs与高ILD发生率相关,但越来越多的ADCs正通过工程改造降低或消除Fc受体相互作用,以减轻潜在的免疫相关不良事件。然而,这些改造的效用目前仍停留在推测阶段——尚无临床数据(即使是跨试验数据)可用于比较仅在Fc受体结合特性上存在差异的ADCs。因此,在设计可能改变Fc功能的结构修饰(如Fc突变、位点特异性偶联或糖基化工程)时,需谨慎权衡Fc段沉默、保留或增强带来的潜在利弊。 关于ADCs耐药性的讨论,常聚焦于其特有的耐药机制,如ADCs治疗后靶点抗原表达缺失。在靶向CD30、CD33、Nectin-4和HER2的ADCs中,均观察到靶点抗原表达降低的现象。类似地,靶点抗原也常发生突变,例如HER2胞外域截短、CD33出现缺失靶点表位的剪接变体、TROP2发生影响膜定位的错义突变等。除此之外,还存在其他非抗原依赖性的ADC特有耐药机制,包括溶酶体蛋白水解活性降低及溶酶体膜转运功能异常。 近期研究数据聚焦于载荷相关耐药性。在mBC中,Abelman等人证实,TOP1点突变的出现会导致肿瘤对多种TOP1i载荷产生交叉耐药性。Jacot等人也在部分接受T-DXd治疗的患者中检测到了TOP1突变。其他临床前研究及来自DESTINY-Breast02和DESTINY-Breast03试验的最新临床数据均支持上述发现:在mBC患者中,接受T-DXd治疗后再使用HER2靶向小分子药物或抗体药物,仍可获得疗效。其他临床证据也指向类似结论。一项针对T-DXd治疗后mBC患者的大型真实世界研究发现,与使用另一种TOP1i类ADCs(SG)相比,使用非TOP1i类化疗药物的患者结局更佳。同样,一项纳入111例转移性乳腺癌患者的回顾性分析显示,HER2高表达患者接受携带相同类型载荷的第二种ADCs治疗时,其PFS短于接受携带不同类型载荷ADCs治疗的患者。  有理由质疑这种耐药动态是否适用于HER2阳性癌症以外的肿瘤类型——HER2阳性癌症的特点是癌基因依赖性强且蛋白表达水平异常高。最新数据表明,载荷介导的耐药性并非HER2阳性癌症特有。两项真实世界研究发现,mBC患者在停用SG后接受T-DXd治疗,其PFS和OS均短于未接受过SG治疗的患者。同样,在评估Datopotamab deruxtecan的前瞻性试验TROPION-PanTumor01中,几乎所有有疗效的患者均为未接受过TOP1i类药物治疗的患者。在一项规模较小的试验中,靶向B7-H4且携带抗微管载荷的Emiltatug legadotin,对接受过TOP1i类ADCs治疗后进展的TNBC患者仍具有活性。 药物外排泵是另一种与载荷相关的耐药机制。对2799例接受T-DXd治疗的乳腺癌患者肿瘤样本进行多组学分析发现,多药耐药蛋白1(MDR1)编码基因表达水平较高的患者,无论其HER2表达水平高低(高或低),总生存期均较短。其他研究也发现,P-糖蛋白(另一种与耐药相关的外排泵)表达水平较高的患者,治疗反应更差。在急性髓系白血病(AML)患者中,P-糖蛋白功能较强也与Gemtuzumab ozogamicin治疗反应较差相关。值得注意的是,尿路上皮癌的临床前模型研究发现,通过破坏外排泵功能,可使对ADCs耐药的细胞重新恢复敏感性。 目前已有多项前瞻性试验正在评估既往接受过TOP1i类ADCs治疗的患者使用TOP1i类ADCs的疗效,这些试验包括TRADE-DXd(NCT06533826)、SATEEN(NCT06100874)、SERIES(NCT06263543)和ENCORE(NCT06774027)。这些研究将有助于明确ADCs序贯治疗的获益——随着ADCs逐渐用于一线治疗和辅助治疗,这一问题变得尤为关键。在HER2靶点以外,多款下一代ADCs正处于临床试验阶段,例如多款靶向nectin-4且携带不同TOP1i载荷的新型ADCs。这些试验中的许多患者此前接受过EV治疗,这为不同载荷之间的疗效比较提供了机会。其中,靶向nectin-4的TOP1i类ADCs SHR-A2102的早期试验结果显示,其对尿路上皮癌患者(包括既往接受过非TOP1i类ADCs治疗的患者)具有良好的治疗活性。 载荷成为ADCs耐药性的核心影响因素,这凸显了开发更多差异化载荷类别的必要性。早期ADCs几乎完全以微管抑制剂或DNA靶向药物为载荷。随后,载荷种类逐渐多样化,其中拓扑异构酶抑制剂的应用显著增加。处于研发阶段的下一代载荷种类更为丰富,包括放射性配体、RNA聚合酶抑制剂、双功能及分子胶降解剂、Bcl-2家族蛋白调节剂和免疫激活剂等。 尽管差异化载荷具有吸引力且有必要开发,但仍需对其进行全面评估。例如,鹅膏毒肽(amanitin toxins)对药物外排泵不敏感,但其较高的全身毒性和亲水性使其应用面临挑战。多款新型载荷的研发失败也凸显了这一领域的挑战:包括NJH395、BDC-1001、SBT6050、SBT6290和TAK-500在内的多款免疫刺激性ADCs已终止研发;两款靶向BCL-XL的偶联物ABBV-155和ABBV-637也已暂停研发;近期,两款Degrader-antibody conjugates(DAC)药物:ABBV-787(靶向BET的双功能降解剂)和ORM-5029(靶向GSPT1的分子胶)也宣布终止研发。 除开发新型治疗药物外,携带多种载荷的ADCs研发工作也在推进中。先进的位点特异性偶联技术已实现对DAR值的精确控制,甚至可构建均一的多载荷ADCs。目前已有两款双载荷ADCs进入临床试验阶段,另有十余款(包括复杂的多载荷构建体)的临床前数据已公布。 双载荷/多载荷策略有望通过结合不同作用机制和非重叠毒性谱,实现疗效提升、阻断耐药逃逸通路并改善安全性。近期一项临床试验采用靶向不同靶点且携带不同载荷的ADCs(SG和EV)联合治疗尿路上皮癌,虽显示出较高的治疗活性,但毒性也高于单独使用任一药物。目前尚不清楚:在单一抗体骨架上同时递送多种载荷是否会产生协同效应(甚至相加效应),以及由此带来的治疗获益增量是否能抵消更高毒性风险及交叉耐药性选择风险。 过去40年间,我们对ADCs的认知取得了显著进展,但仍有诸多问题亟待阐明。这一现象或许并不意外:即使是已广泛应用数十年的传统化疗药物,其治疗指数背后的机制也仅被部分理解。而ADCs的机制更为复杂,其疗效依赖于靶点表达、linker稳定性、裂解机制、组织对载荷的特异性敏感性、免疫相互作用及肿瘤微环境复杂性等多方面因素的综合作用。 要充分发挥ADCs的治疗潜力,需在多个领域取得突破:开发更优的检测方法、发现新型生物标志物,以及在抗体工程、载荷多样化和linker设计方面持续创新。同样重要的是,基于数据的临床进展——制定以患者为中心的给药方案、治疗顺序及联合用药策略,以最大化疗效并确保耐受性。我们预计,随着大量ADCs临床试验不断产生新的认知,ADCs治疗将很快从单纯的经验性方法,向更依赖机制指导的模块化设计转变,最终开发出更安全、更具选择性且更有效的治疗方案。
有理由质疑这种耐药动态是否适用于HER2阳性癌症以外的肿瘤类型——HER2阳性癌症的特点是癌基因依赖性强且蛋白表达水平异常高。最新数据表明,载荷介导的耐药性并非HER2阳性癌症特有。两项真实世界研究发现,mBC患者在停用SG后接受T-DXd治疗,其PFS和OS均短于未接受过SG治疗的患者。同样,在评估Datopotamab deruxtecan的前瞻性试验TROPION-PanTumor01中,几乎所有有疗效的患者均为未接受过TOP1i类药物治疗的患者。在一项规模较小的试验中,靶向B7-H4且携带抗微管载荷的Emiltatug legadotin,对接受过TOP1i类ADCs治疗后进展的TNBC患者仍具有活性。 药物外排泵是另一种与载荷相关的耐药机制。对2799例接受T-DXd治疗的乳腺癌患者肿瘤样本进行多组学分析发现,多药耐药蛋白1(MDR1)编码基因表达水平较高的患者,无论其HER2表达水平高低(高或低),总生存期均较短。其他研究也发现,P-糖蛋白(另一种与耐药相关的外排泵)表达水平较高的患者,治疗反应更差。在急性髓系白血病(AML)患者中,P-糖蛋白功能较强也与Gemtuzumab ozogamicin治疗反应较差相关。值得注意的是,尿路上皮癌的临床前模型研究发现,通过破坏外排泵功能,可使对ADCs耐药的细胞重新恢复敏感性。 目前已有多项前瞻性试验正在评估既往接受过TOP1i类ADCs治疗的患者使用TOP1i类ADCs的疗效,这些试验包括TRADE-DXd(NCT06533826)、SATEEN(NCT06100874)、SERIES(NCT06263543)和ENCORE(NCT06774027)。这些研究将有助于明确ADCs序贯治疗的获益——随着ADCs逐渐用于一线治疗和辅助治疗,这一问题变得尤为关键。在HER2靶点以外,多款下一代ADCs正处于临床试验阶段,例如多款靶向nectin-4且携带不同TOP1i载荷的新型ADCs。这些试验中的许多患者此前接受过EV治疗,这为不同载荷之间的疗效比较提供了机会。其中,靶向nectin-4的TOP1i类ADCs SHR-A2102的早期试验结果显示,其对尿路上皮癌患者(包括既往接受过非TOP1i类ADCs治疗的患者)具有良好的治疗活性。 载荷成为ADCs耐药性的核心影响因素,这凸显了开发更多差异化载荷类别的必要性。早期ADCs几乎完全以微管抑制剂或DNA靶向药物为载荷。随后,载荷种类逐渐多样化,其中拓扑异构酶抑制剂的应用显著增加。处于研发阶段的下一代载荷种类更为丰富,包括放射性配体、RNA聚合酶抑制剂、双功能及分子胶降解剂、Bcl-2家族蛋白调节剂和免疫激活剂等。 尽管差异化载荷具有吸引力且有必要开发,但仍需对其进行全面评估。例如,鹅膏毒肽(amanitin toxins)对药物外排泵不敏感,但其较高的全身毒性和亲水性使其应用面临挑战。多款新型载荷的研发失败也凸显了这一领域的挑战:包括NJH395、BDC-1001、SBT6050、SBT6290和TAK-500在内的多款免疫刺激性ADCs已终止研发;两款靶向BCL-XL的偶联物ABBV-155和ABBV-637也已暂停研发;近期,两款Degrader-antibody conjugates(DAC)药物:ABBV-787(靶向BET的双功能降解剂)和ORM-5029(靶向GSPT1的分子胶)也宣布终止研发。 除开发新型治疗药物外,携带多种载荷的ADCs研发工作也在推进中。先进的位点特异性偶联技术已实现对DAR值的精确控制,甚至可构建均一的多载荷ADCs。目前已有两款双载荷ADCs进入临床试验阶段,另有十余款(包括复杂的多载荷构建体)的临床前数据已公布。 双载荷/多载荷策略有望通过结合不同作用机制和非重叠毒性谱,实现疗效提升、阻断耐药逃逸通路并改善安全性。近期一项临床试验采用靶向不同靶点且携带不同载荷的ADCs(SG和EV)联合治疗尿路上皮癌,虽显示出较高的治疗活性,但毒性也高于单独使用任一药物。目前尚不清楚:在单一抗体骨架上同时递送多种载荷是否会产生协同效应(甚至相加效应),以及由此带来的治疗获益增量是否能抵消更高毒性风险及交叉耐药性选择风险。 过去40年间,我们对ADCs的认知取得了显著进展,但仍有诸多问题亟待阐明。这一现象或许并不意外:即使是已广泛应用数十年的传统化疗药物,其治疗指数背后的机制也仅被部分理解。而ADCs的机制更为复杂,其疗效依赖于靶点表达、linker稳定性、裂解机制、组织对载荷的特异性敏感性、免疫相互作用及肿瘤微环境复杂性等多方面因素的综合作用。 要充分发挥ADCs的治疗潜力,需在多个领域取得突破:开发更优的检测方法、发现新型生物标志物,以及在抗体工程、载荷多样化和linker设计方面持续创新。同样重要的是,基于数据的临床进展——制定以患者为中心的给药方案、治疗顺序及联合用药策略,以最大化疗效并确保耐受性。我们预计,随着大量ADCs临床试验不断产生新的认知,ADCs治疗将很快从单纯的经验性方法,向更依赖机制指导的模块化设计转变,最终开发出更安全、更具选择性且更有效的治疗方案。



