来源:芒果师兄
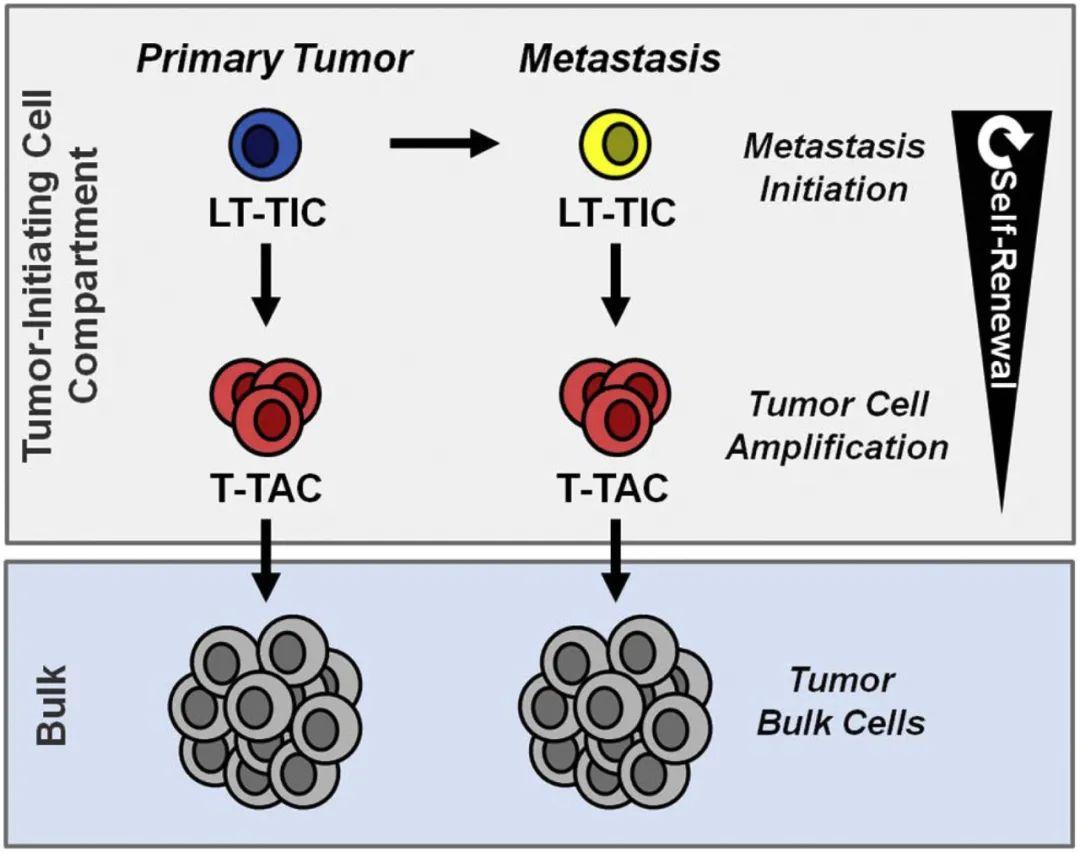
肿瘤起始细胞(Tumor-initiating cells,TICs),也称为癌症干细胞 (CSC),是一小部分具有长期肿瘤形成能力的肿瘤细胞,在癌症的发展和治疗抵抗中起着关键作用。然而,由于缺乏对 TICs 漏洞的识别,针对 TICs 的有效疗法开发进展缓慢。就像正常干细胞受特定微环境(干细胞龛)的外部信号调控一样,TICs 的干细胞样状态及其后代的恶性表型也受 TIC 相关肿瘤微环境(TIC 龛)的各种因素控制。因此,理解 TICs 与 TIC 龛之间相互作用的机制,可能加速持久性癌症治疗药物的开发。
2020年,由来自美国俄勒冈健康与科学大学的研究团队在Science发表了题为Tumor-initiating cells establish an IL-33-TGF-β niche signaling loop to promote cancer progression的论著,揭示了 TICs 与 FcεRIα+ 巨噬细胞之间 IL-33-TGF-β 龛信号环路的细胞和分子基础,这一环路在鳞状细胞癌(SCC)的恶性进展和药物抗性中起着关键作用。这一发现为破坏 TICs 以提高癌症治疗效果提供了潜在的新靶点。

研究者使用小鼠SCC模型,之前的研究表明,转化生长因子 β(TGF-β)诱导产生具有药物抗性的 TICs,这些 TICs 产生侵袭性、分化差的后代。研究者观察到这些对 TGF-β 反应的肿瘤细胞与相邻基质中局部 TGF-β 表达在空间上相关。因此,研究团队假设 TICs 可能向相邻基质发送特定的信号分子,以诱导支持 TIC 的龛。
主要研究结果:
一. IL-33 的发现:研究人员发现,在 TGF-β 反应的 TICs 中,白细胞介素 -33(IL-33)是上调最显著的细胞因子。正常情况下,IL-33 存储在细胞核中,但在 TGF-β 反应的 TICs 中,IL-33 被释放到细胞外空间,这与 Nrf2 介导的抗氧化反应有关,是 TGF-β 反应 TICs 的标志。
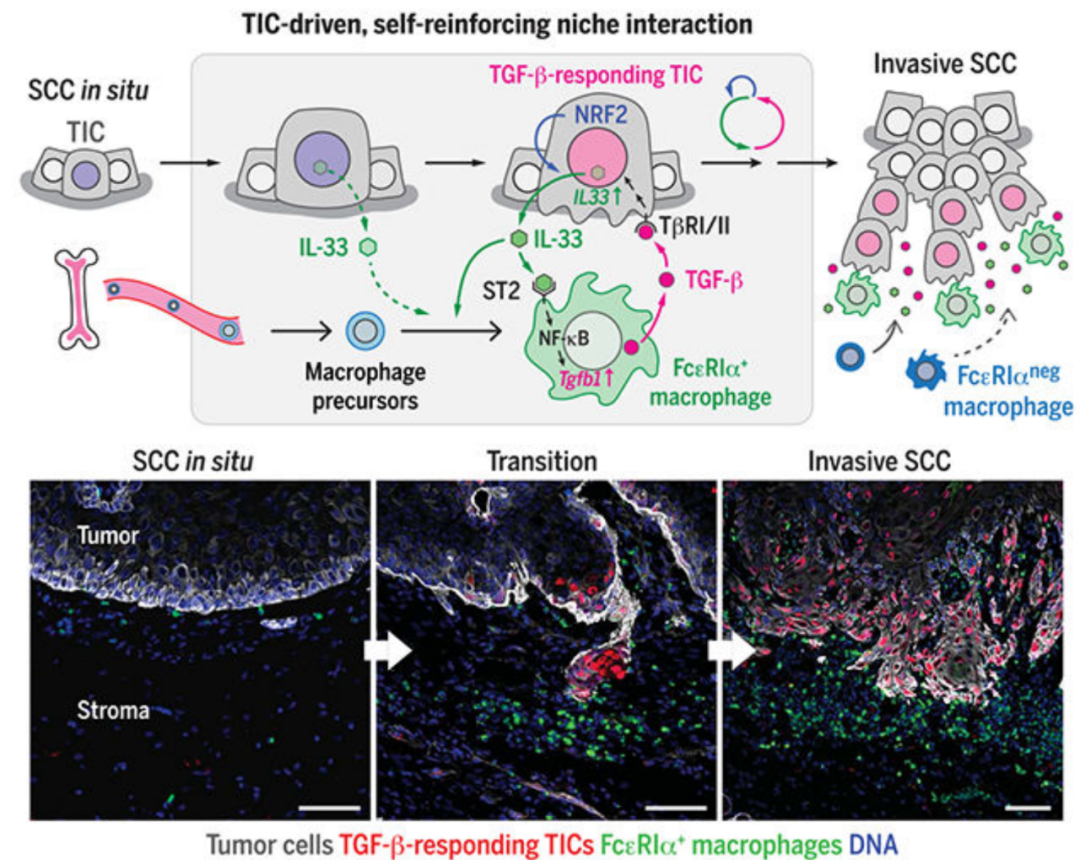
Fig1. 在TGF-β应答肿瘤细胞中发现IL-33表达上调
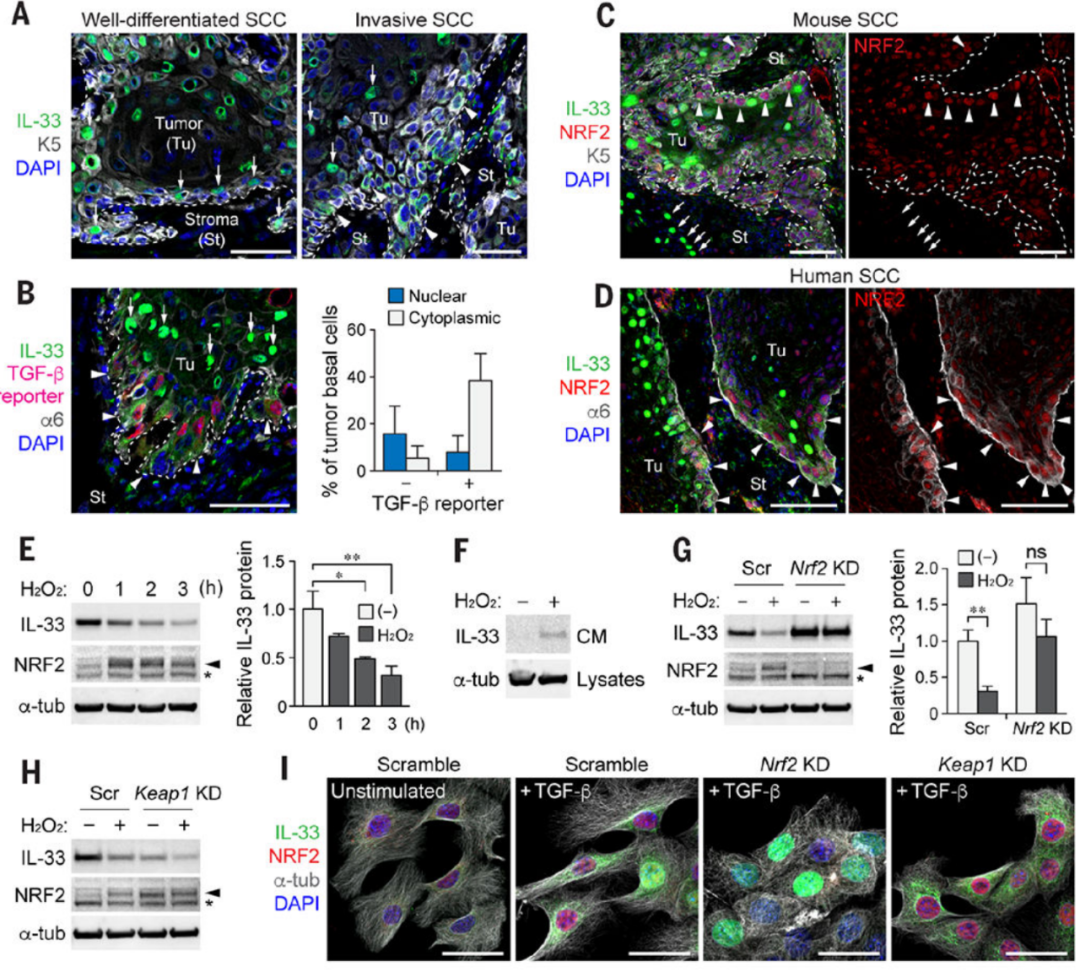
Fig2. NRF2介导的抗氧化反应引起IL-33的细胞外释放
二. IL-33 与肿瘤进展的关系:TICs 释放的 IL-33 对 SCC 的侵袭性进展和药物抗性至关重要。机制上,IL-33 诱导在 TICs 附近(50 微米半径内)积累表达 IL-33 受体 ST2 和高亲和力 IgE 受体(FcεRIα)的肿瘤相关巨噬细胞亚群。这些之前未被充分认识的 FcεRIα+ 巨噬细胞是从骨髓源性细胞分化而来,并通过 IL-33-ST2-NF-κB 通路创造富含 TGF-β 的龛微环境,诱导对 TICs 的旁分泌 TGF-β 信号,并进一步上调 IL-33 表达。阻断该通路或耗尽 FcεRIα+ 巨噬细胞可减少对 TGF-β 反应的 TICs 数量、侵袭性肿瘤进展速率和化疗抗性。
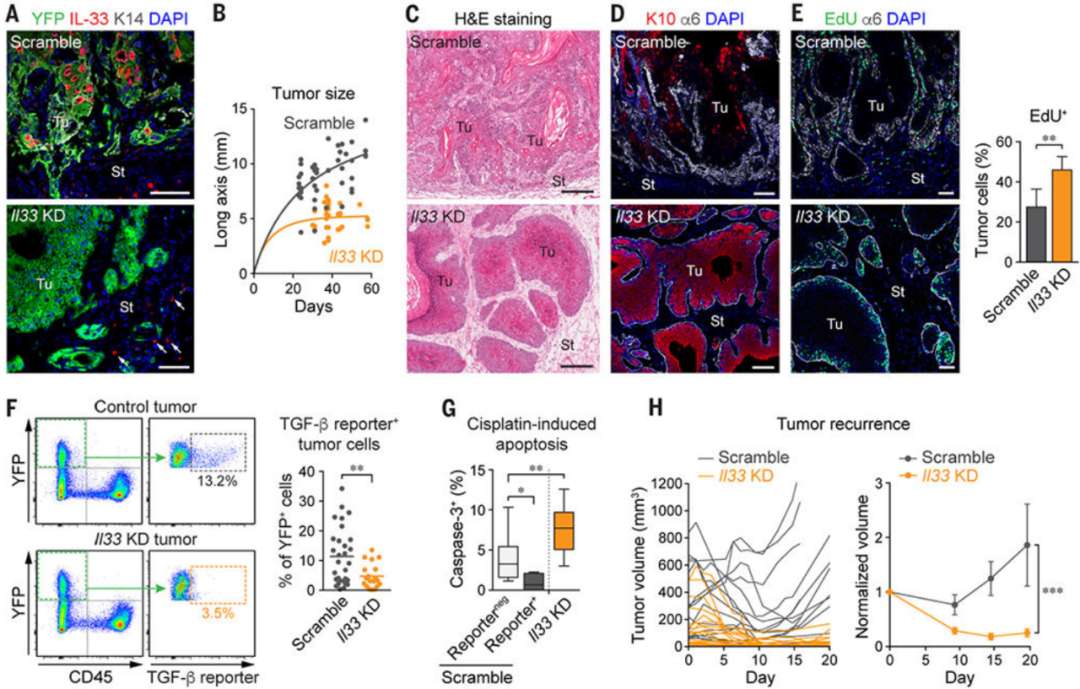
Fig3. 肿瘤细胞分泌的IL-33促进TGF-β旁分泌信号传导,细胞侵袭性和耐药性
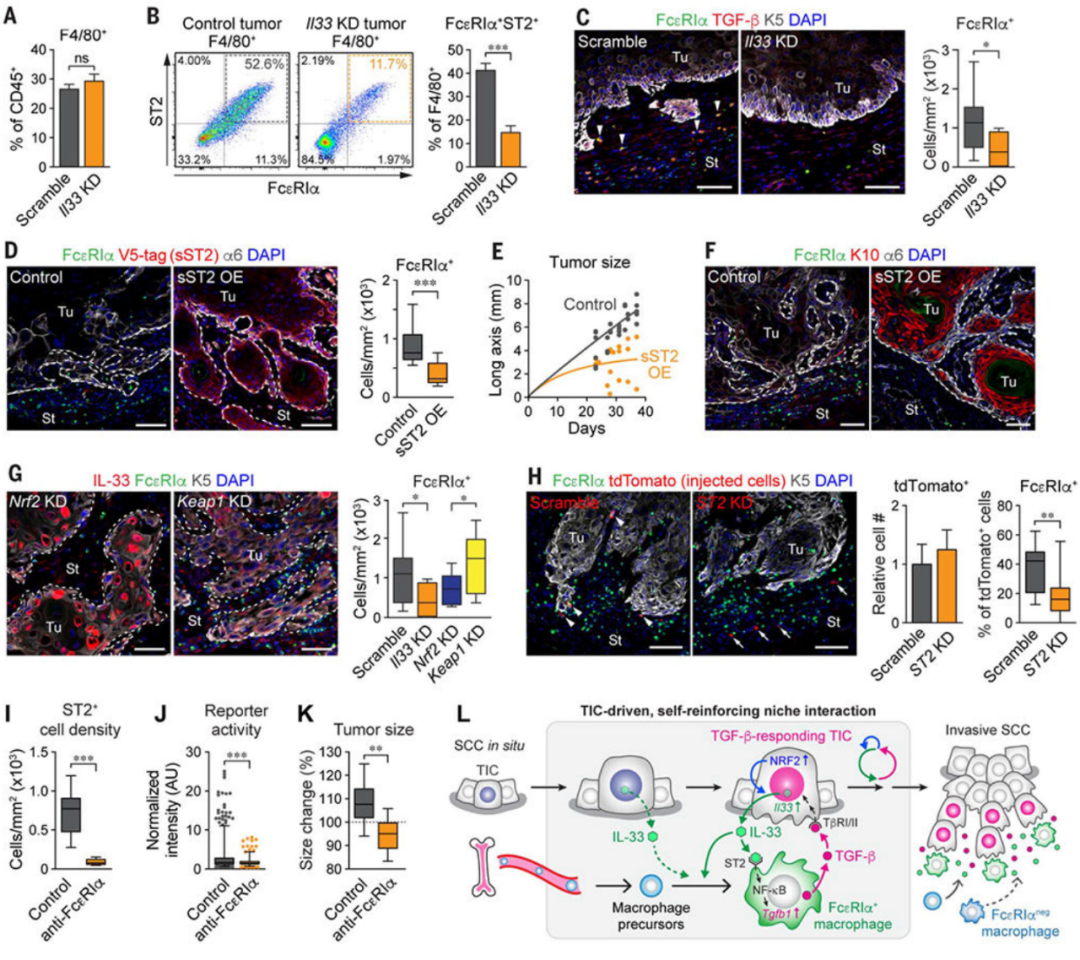
Fig6. TICs通过分泌的IL-33积累FcεRIα+巨噬细胞以创建富含TGF-β的肿瘤微环境
研究意义:这项研究为理解 TICs 与肿瘤微环境之间的相互作用提供了新的视角。通过揭示 IL-33-TGF-β 龛信号环路,为开发新的癌症治疗策略提供了理论基础。未来的研究可以进一步探索这一信号环路在其他类型癌症中的作用,以及寻找能够特异性靶向这一环路的药物,从而为癌症治疗带来新的希望。
小思考:在临床实践中,许多癌症患者在接受治疗后会出现复发和转移,这与 TICs 的存在密切相关。本文的研究结果提示我们,针对 TICs 与其微环境之间的信号通路进行干预,可能成为一种有效的治疗策略。例如,通过阻断 IL-33 或 TGF-β 信号,或者耗尽 FcεRIα+ 巨噬细胞,或许能够削弱 TICs 的侵袭性和药物抗性,从而提高癌症治疗的成功率。此外,这项研究还强调了肿瘤微环境在癌症发展中的重要性。肿瘤微环境中的免疫细胞,如巨噬细胞,通常被认为是促进肿瘤进展的因素。然而,本文发现特定亚群的巨噬细胞(FcεRIα+ 巨噬细胞)在 TICs 的维持和癌症进展中发挥着关键作用。这提示我们在未来的癌症治疗中,可能需要更加精准地靶向特定的免疫细胞亚群,而不是笼统地调节整个免疫系统。总之,关于TICs可以深挖的点还有很多!推荐大家看看这篇经典文献的原文,行文逻辑性很强,而且每张免疫荧光的图片都精美绝伦,值得学习!




