来源:医药魔方pro
PROTAC通过招募E3泛素连接酶诱导目标蛋白的泛素化降解,为癌症治疗提供了新策略。然而,目前仅有少数E3连接酶(如CRBN、VHL)被成功应用于PROTAC开发,限制了其靶标范围。
4月28日,天津医科大学董城、石磊、陈东星、谢松波团队合作,在Nature Structural & Molecular Biology杂志发表论文,首次将E3连接酶GID4(glucose-induced degradation deficient complex 4,葡萄糖诱导降解缺陷复合物4)应用于PROTAC分子设计。
研究团队设计了基于GID4的PROTAC,实现了多个致病蛋白的靶向降解,并解析了GID4-PROTAC-BRD4三元复合物的晶体结构,系统阐明了GID4介导底物降解的分子机制。此外,他们据此开发出高效降解剂NEP162,成功实现BET家族蛋白BRD4的精准清除。

研究人员先前已经开发出一种靶向GID4拮抗剂的PFI-7,于是他们假设PFI-7可作为E3连接酶的配体,应用在PROTAC分子中。于是他们将PFI-7与BRD4抑制剂JQ1连接,并通过改变连接链长度,设计了一系列PROTAC分子。
通过细胞实验,研究人员发现PROTAC分子NEP108可以降解BRD4,而阴性对照则没有活性。这表明PFI-7可以有效地招募GID4,并促进BRD4的降解。
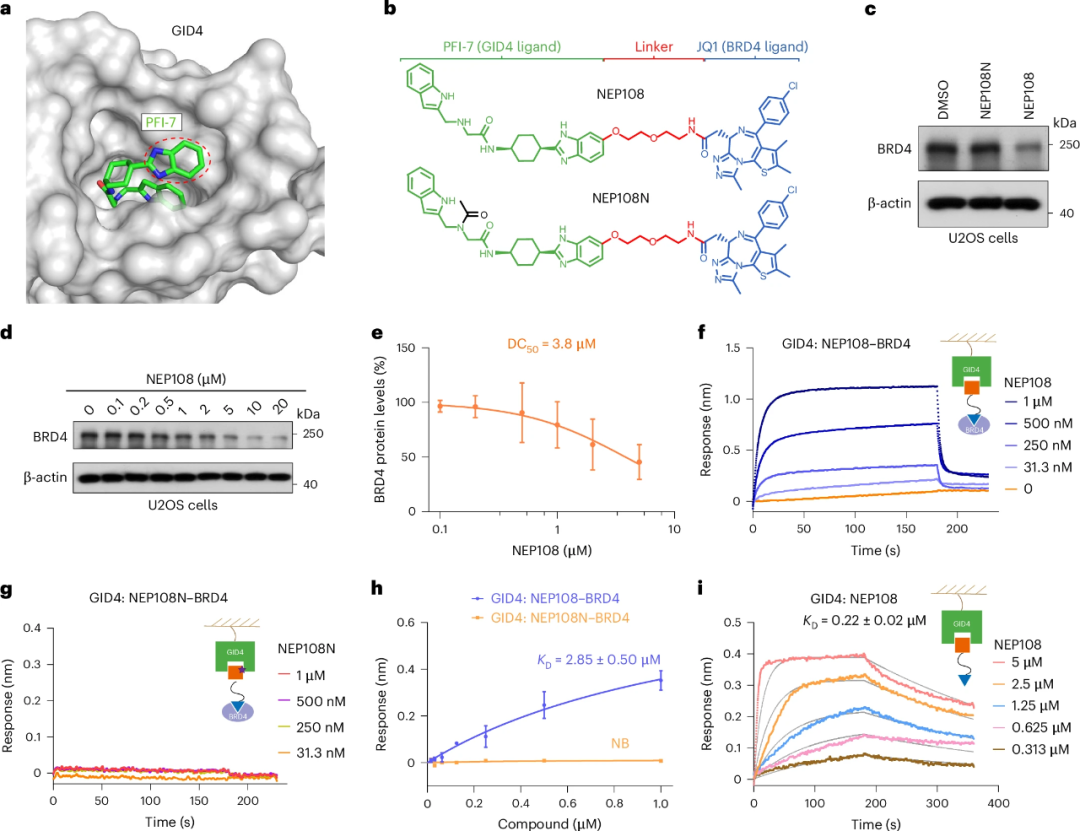
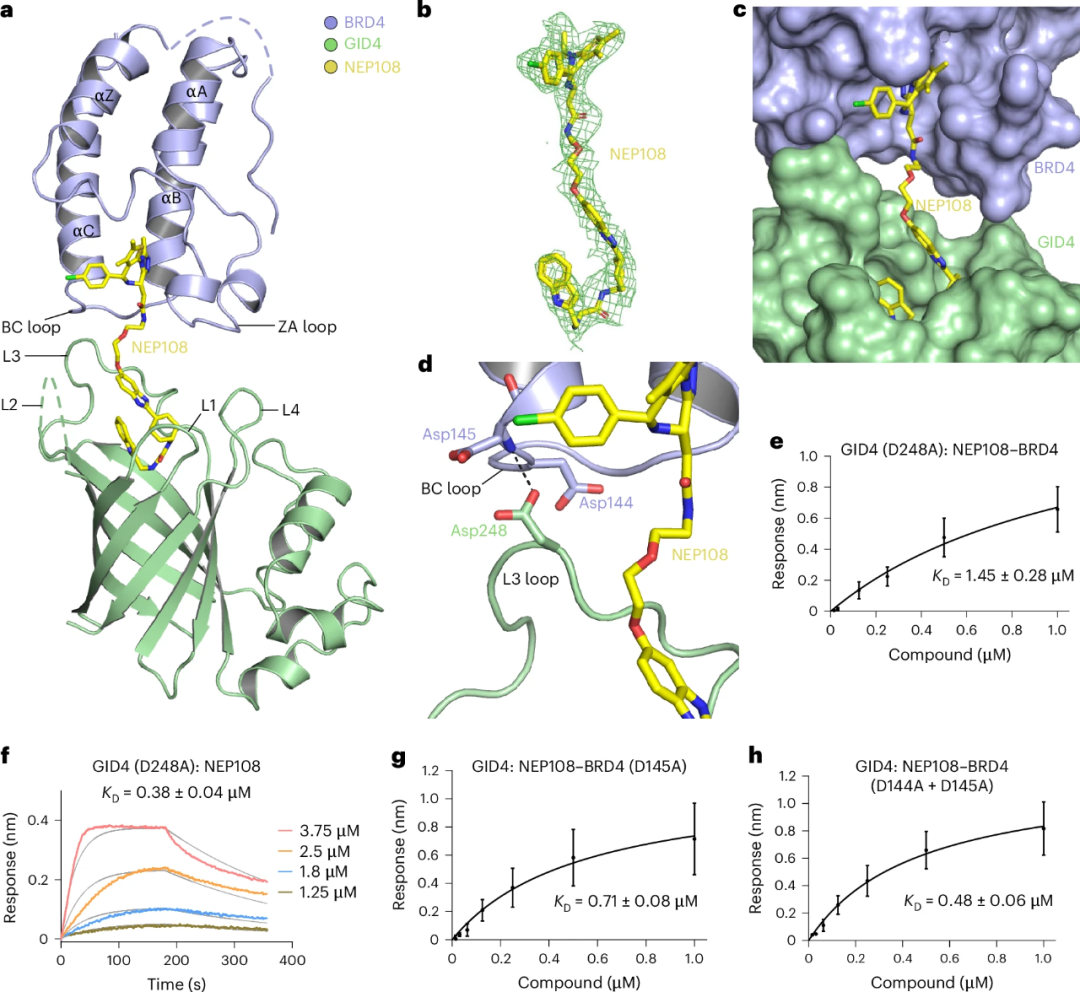
然后,研究人员解析了GID4-NEP108-BRD4三元复合物的晶体结构。其中NEP108分子夹在BRD4和GID4之间,JQ1和PFI-7部分分别与BRD4和GID4的结合位点结合。
研究发现,BRD4的BC环和GID4的L3环相互作用,并形成氢键。这与之前报道的VHL基础PROTAC的作用机制有所不同。此外,连接链长度对PROTAC的活性有重要影响,较短的连接链会导致空间位阻,而较长的连接链则可能不利于三元复合物的形成。
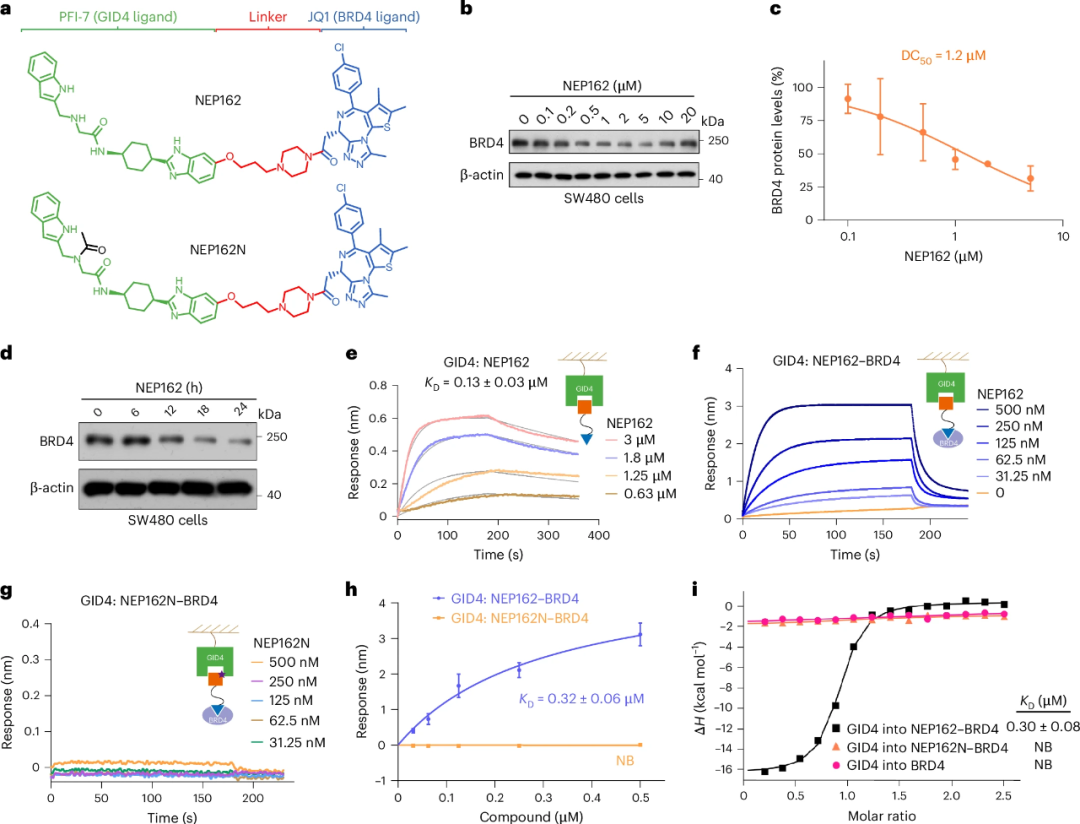
接下来,研究人员在NEP108的基础上进行结构优化,设计了更有效的PROTAC分子NEP162。后续实验发现,NEP162可以更有效地降解BRD4,并具有更强的GID4结合亲和力。
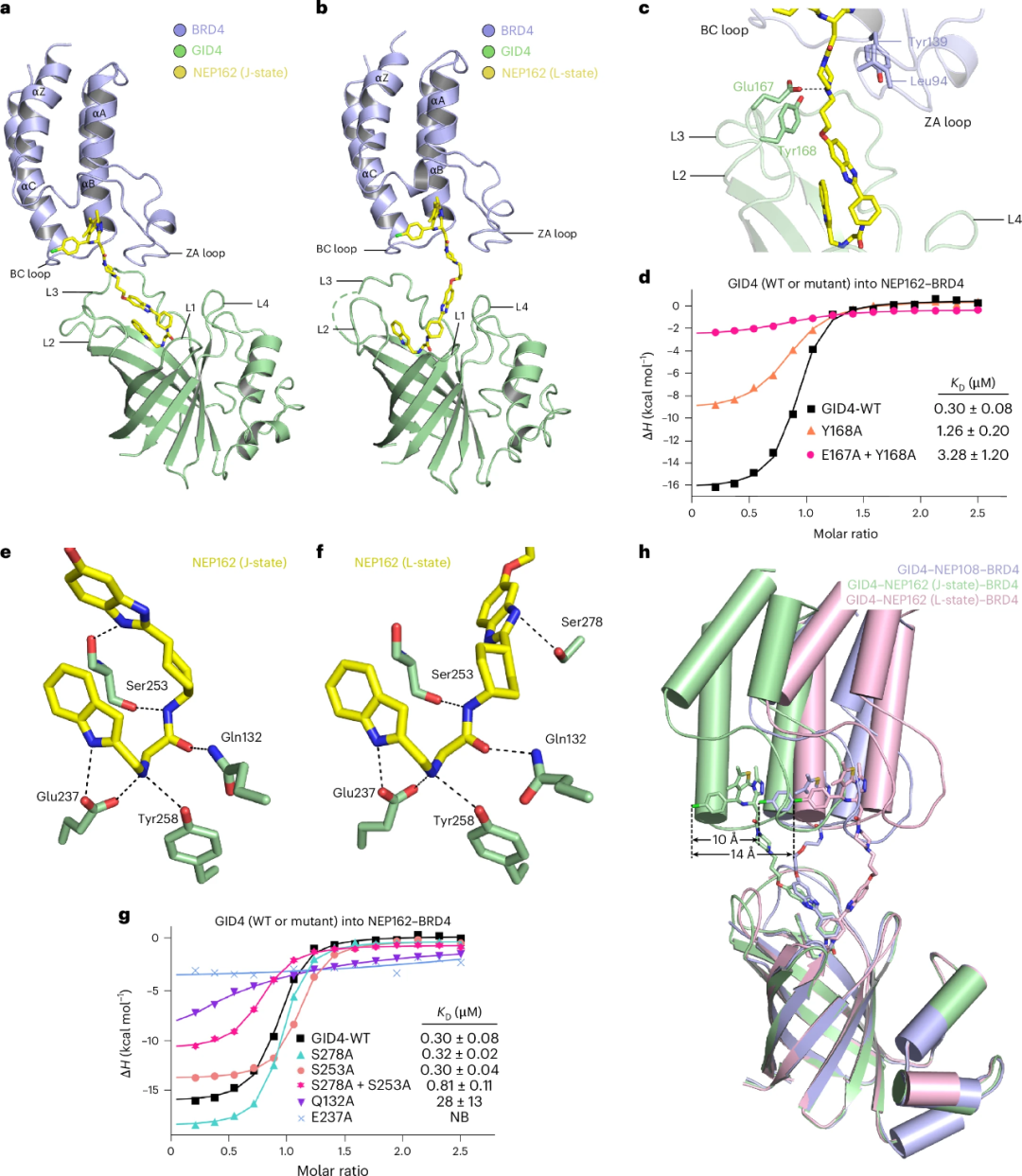
通过晶体结构解析,他们发现了GID4-PROTAC-BRD4三元复合物的动态结合模式:NEP162通过连接子将GID4的底物结合腔与BRD4的溴结构域桥接,诱导两者形成可变构象界面,这解释了其增强活性的原因。
优化后的NEP162在体外展现出纳摩尔级降解效力(DC50=1.2μM),并通过泛素-蛋白酶体系统依赖的方式显著抑制癌细胞增殖。
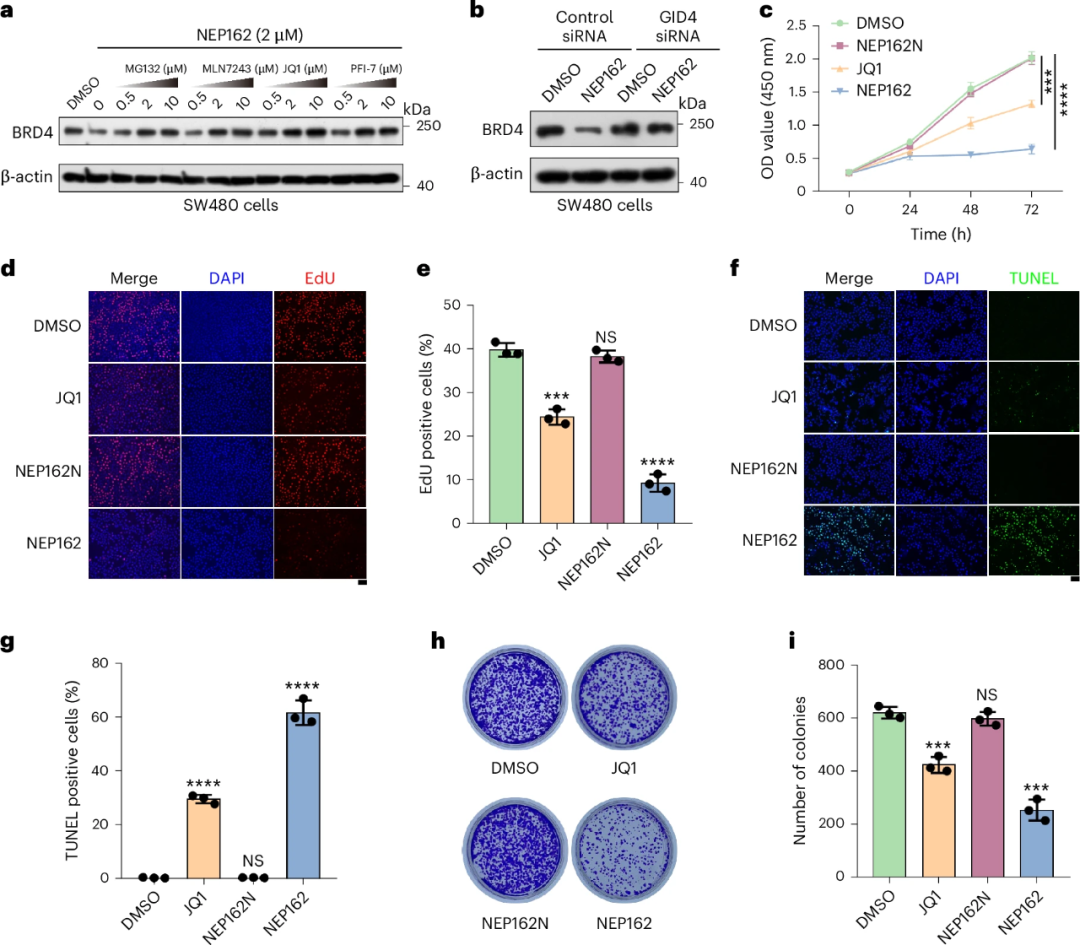
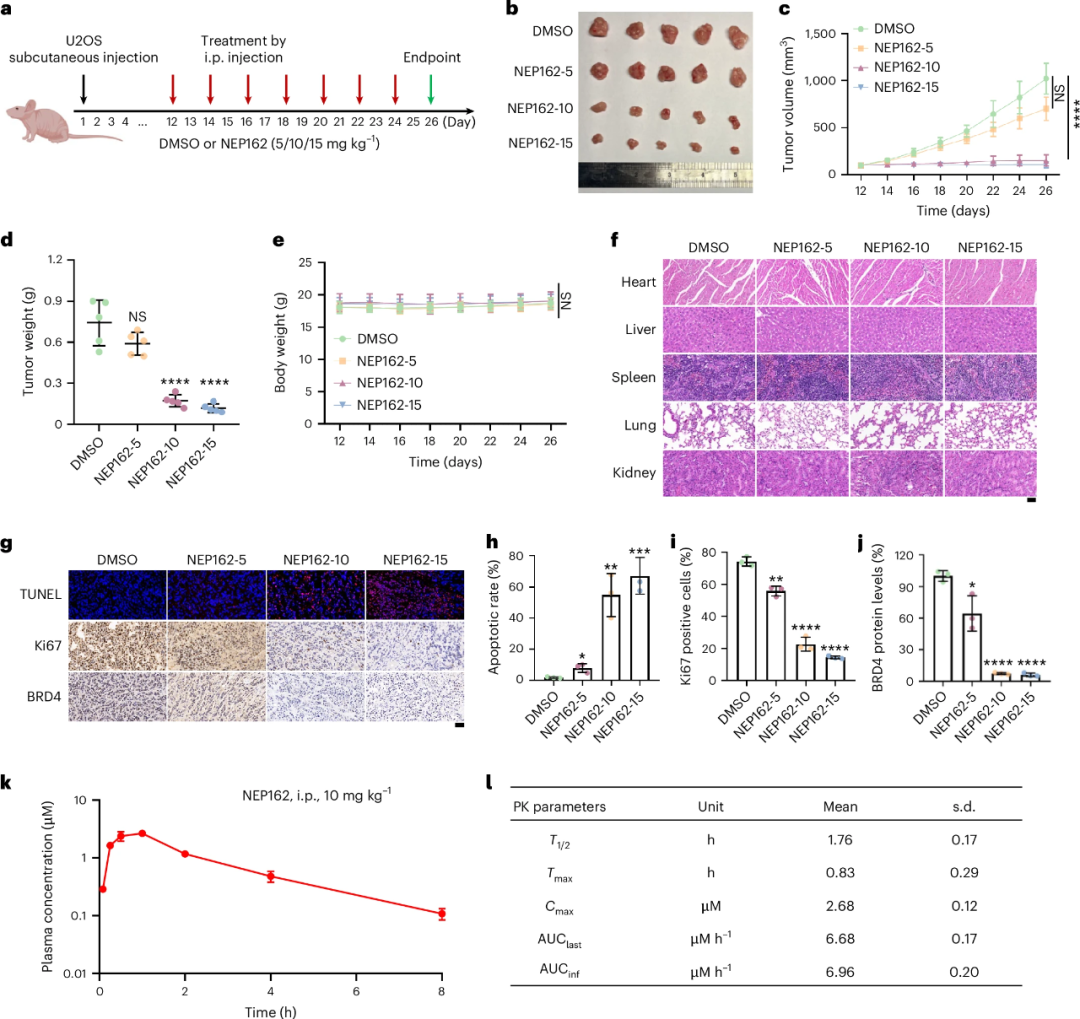
在异种移植瘤模型中,NEP162(10mg/kg)治疗显著降低肿瘤内BRD4水平,诱导细胞凋亡,抑制肿瘤生长且无明显毒性。
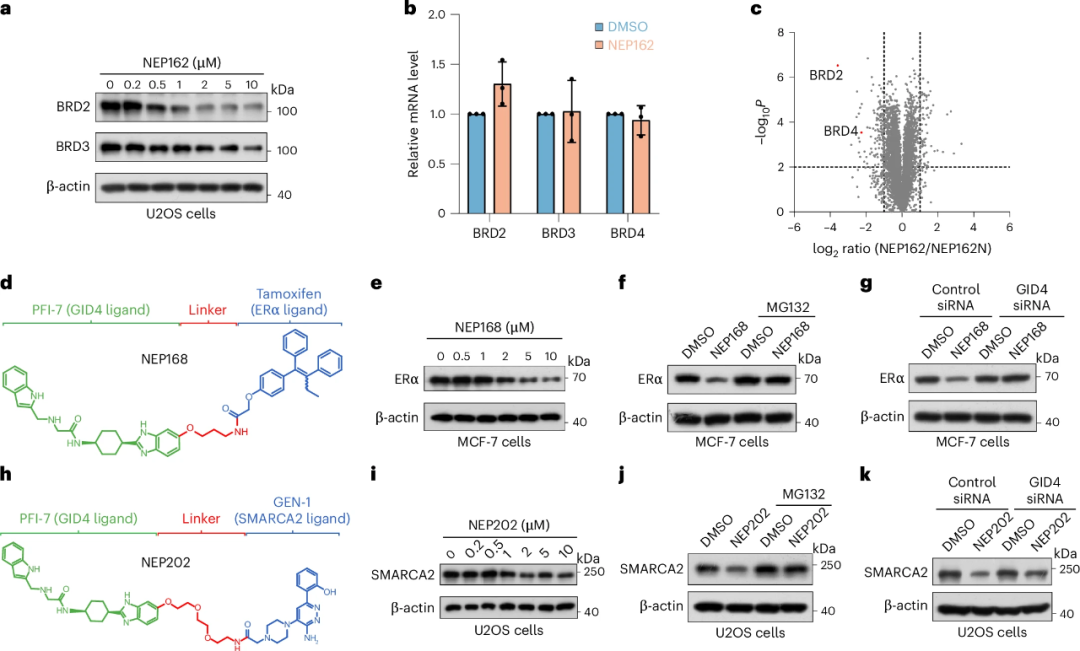
MARCA2等其他靶标,证明其广泛适用性。
总结来说,该研究开发了新的E3连接酶GID4,并成功应用于PROTAC设计。该工作不仅丰富了PROTAC可用的E3连接酶库,为“不可成药”靶点提供新工具,同时通过结构驱动的设计策略,为开发高效降解剂奠定了分子基础。



