原创为:乌拉乌拉 来源于:生物制药小白
概述
本文概述了噬菌体展示技术在展示、筛选、策略等方面的进展,是一篇值得进一步深入探究的综述。后续公众号会依照本文对噬菌体展示技术的各部分进行经典文献内容提取展示。主要内容概述如下:
1、抗原展示:直接或间接固定展示;通过脂质体、纳米盘和 VLPs 展示;全细胞淘选展示
2、筛选技术:负筛(抗原标签、载体、脂质体、纳米盘和 VLPs、全细胞、表位特异性去除、复杂抗原混合物的去除 )、竞争筛选、交叉淘选、抗体阻断、NGS技术、共同抗原、环境名感条件筛选
3、特殊文库设计:双特异性文库、共同轻链文库、共同重链文库、CDR-H3文库、侧-环文库、组氨酸富集文库、
4、一般文库设计重点:抗原免疫原性要求、多样性要求、文库侧重设计(扩增特定种系、删除不利种系、删除某些影响工艺的序列等)
正文
简介
噬菌体展示技术最早发明于 1985 年,用于展示多肽,后来在 1990 年,第一个抗体片段被展示在噬菌体上。从那时起,该技术已成功用于发现数百种抗体,用于研究、诊断和治疗,其中超过 14 种抗体获得临床批准。噬菌体展示方法的各个方面都得到了改进和提高,从而能够发现针对具有挑战性靶点的抗体和具有特定结合特性的抗体。与其他展示技术相比(如核糖体、酵母或哺乳动物展示技术),噬菌体展示的优势之一是可以创建大型文库(多样性大于 10 的 11 次方个独特的克隆)并存储以备选择,从而可以发现针对广泛抗原的高亲和力抗体。在本综述中,我们将讨论四个主要参数,这四个主要参数可以通过优化来改善抗体发现活动的结果:抗体展示形式的选择、抗原展示、选择策略和文库构建。
噬菌体展示文库中使用的抗体形式
噬菌体展示文库可以使用不同的噬菌体来展示各种不同的抗体形式,如丝状 M13、fd 和 f1 噬菌体。两种最常用的形式是单链可变片段(scFvs) 和抗原结合片段 (Fabs)。ScFvs 是由 VH 和 VL 结构域通过短的多肽连接子组成的小型(25-27 kDa)单价抗体片段。Fabs 大小为 50 kDa,由 VH、VL、CL 和 CH1 结构域组成。ScFv 转换为 Fab/IgG 形式时可能会失去亲和力,这点在以 Fab 形式发现的抗体上则很少出现。但是,Fab 通常比 scFvs 的表达率低,在噬菌体上的展示水平也较低,因此,scFvs 是一种更稳健的文库形式,尤其是在天然库中。
其他抗体形式也可用于构建抗体噬菌体展示文库,包括人单域抗体(人 VH)以及驼科和鲨鱼单域抗体(分别为 VHH 和 VNAR)。VHHs 较小(12-15 kDa),由纯重链抗体的抗原结合片段组成。在传统抗体中,介导 VH 和 VL 配对的界面包含被掩埋在界面中的疏水残基。在 VHHs 中,这些残基被亲水性更强的残基所取代,从而提高了水溶性,降低了形成聚集体的趋势。与传统抗体相比,VHH 中的互补性决定区 3(CDR3)环通常被拉长,这使得 VHH 能够结合传统抗体不能结合的抗原,如酶活受体结构域的催化区域。VNAR 抗体片段在大小上与 VHH 抗体片段相似,但有一个明显的例外,即它只有两个 CDR 环,因为 Fr2- CDR2 区域的大部分被删除了。
在噬菌体展示活动中选择哪种抗体形式取决于所发现抗体的最终用途。如果应用是治疗性的且需要长半衰期,或者需要效应细胞的参与,scFv 或 Fab 库可能是最佳选择,因为它们可以很容易地重新转换为常用的治疗用 IgG 形式。对于研究试剂和诊断应用,或者当大规模生产的成本是主要考虑的问题时,VHH 等形式可能是最理想的选择,尽管这种形式也可以与 Fc 区域融合,形成 VHH-Fc 分子,在半衰期和效应细胞参与方面具有与 IgG 相似的特性。总之,明确最终抗体产品的要求对于选择最合适的库类型至关重要。
抗原展示策略
对于一个成功的基于噬菌体展示的抗体发现项目来说,所含抗原的构象必须与最终应用中抗原的构象相似。否则,发现的抗体最终只能识别改变了构象的抗原。因此,噬菌体展示活动的第一步也是关键的一步是确定抗原展示的最佳方法。
1、通过直接或间接固定进行抗原展示
最广泛使用的抗原展示策略是将抗原直接或间接的固定在表面上(图 1a)。在直接固定法中,抗原通过被动吸附涂布在表面上。这种方法是迄今为止最简单的抗原展示方法;但它并不适合许多其他类型的抗原,因为这些抗原在吸附后会改变其原生构象。对于小抗原来讲这种方法存在特别大的问题,因为该方法不能完全展示分子间的相互作用力以发挥被动吸附作用。对于上述抗原的其中一部分来讲,间接固定法可用来替代直接固定法。
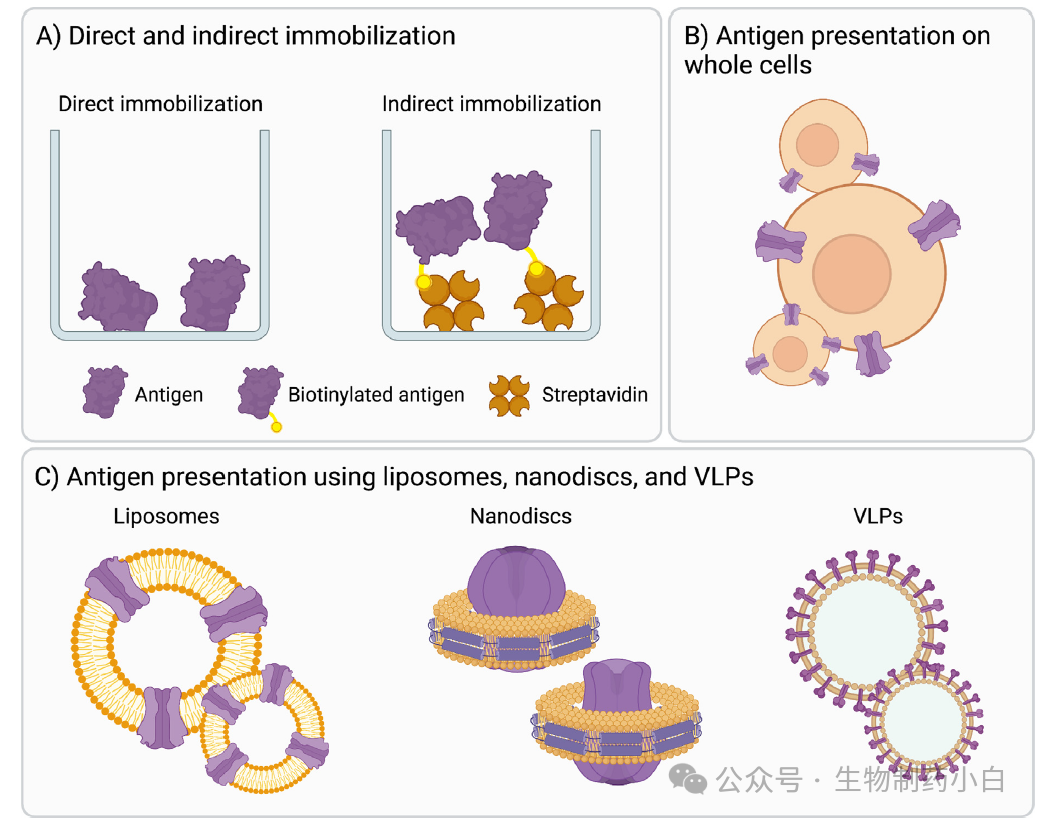
图1
通过间接固定,抗原被一种捕获分子捕获到表面。最流行的技术是利用链霉亲和素/中性亲和素与生物素之间的强结合力,在表面包被链霉亲和素/中性亲和素,抗原通过连接子或标签与生物素结合。这会使得抗原与表面有间接且稳定的结合。间接固定法更能使抗原最大程度的保留原始构象,因为抗原是突出于筛选表面的。然而,至关重要的是不要使抗原过度生物素化,因为这会掩盖重要的表位或导致抗原聚集。
生物素化有两种不同的方法:位点特异生物素化和随机生物素化。位点特异生物素化可以使用包含酶生物素化位点的生物素化受体多肽(BAPs)来实现。AviTag 是最常用的一种 BAPs,需要将抗原与 15 个氨基酸多肽的标签融合并重组表达。AviTag 序列的生物素化发生在赖氨酸残基上,通过大肠杆菌生物素酶 BirA 实现的。AviTagged 抗原可在细菌细胞、酵母和哺乳动物细胞中与 BirA 共同表达,以实现体内生物素化。此外,纯化的AviTagged 抗原可以和纯化的 BirA 以及生物素共孵育,实现体外生物素化。利用 BAPs 的生物素化是位点特异性的,每个抗原只有一个生物素,因此可以控制抗原生物素的比例,避免过度生物素化。尽管如此,在某些情况下可能无法使用 AviTag 系统,特别是目标抗原难以或无法重组表达时,或 AviTag 会干扰抗原的潜在的重要(末端)表位时。
随机化学生物素化法可作为 BAP 生物素化的替代方法。在这种方法中,纯化的抗原和生物素化试剂通过各种可能的化学反应混合,以实现抗原和生物素之间的共价连接。有多种连接子可供选择,可连接生物素化抗原的主要胺基(赖氨酸 N末端或侧链)或巯基和羧基。虽然化学生物素化比酶法生物素化(通过大肠杆菌生物素连接酶)更快、更便宜,但其需要滴定才能达到所需的 1:1 的抗原生物素比例。
抗原的间接固定可基于不同的肽标签和标签特异性捕获分子。这需要融合肽标签的抗原重组表达以及筛选表面和融合的标签特异性捕获分子共包被。标签和捕获分子间的结合导致抗原的固定。尽管与生物素-链霉亲和素系统相比,His-标签和抗-His抗体或其他 His 捕获分子不那么流行,但它们已被用于噬菌体展示中的抗原展示。最近,从变形链球菌中的纤连蛋白结合蛋白中提取的肽-蛋白配体对,即 SpyTag/SpyCatcher,被用于噬菌体展示筛选中的抗原展示。Spy 标签和 Spy 捕获分子之间的结合是通过异肽键实现的,在各种条件下,如 pH、温度和缓冲体系中,都证实这是一种不可逆、特异且扎实的方法。
2、通过全细胞淘选进行抗原展示
尽管间接固定适合于展示许多抗原,但当它要展示膜蛋白等抗原时,往往不是最佳选择。膜蛋白通常包含疏水跨膜区并且可能是多个亚单位蛋白复合体的一部分;因此,将他们从自然环境中分离后经常会丢失原始构象。为保持其构象,膜蛋白可在细胞膜上表达(图 1b)。哺乳动物细胞系,如人胚肾(HEK)细胞或中国仓鼠卵巢(CHO)细胞,可以瞬时或稳定地转染目标蛋白,使其过度表达并在细胞表面获得高密度,同时保留抗原的原生构象。虽然有时会使用培养的原代细胞进行筛选,但事实证明,与原代细胞相比,培养的细胞会改变蛋白质的表达水平;为克服这一潜在问题,可使用未经培养的原代细胞进行筛选。其他细胞表达系统,包括大肠杆菌、酵母和昆虫细胞,也可用于表达和呈现膜蛋白。
在全细胞上进行噬菌体展示筛选的一个问题是,目标抗原,无论是内源的还是重组表达的,都只占展示文库总蛋白的一小部分。为克服这一问题,可采用下文所述的负筛技术。此外,在使用转染细胞时,可在两轮筛选之间改变宿主细胞,以集中筛选存在于两种细胞上的重组抗原。另一个挑战是噬菌体颗粒可通过其外壳蛋白(与其展示的抗体片段无关)非特异性地吸附到细胞表面。为了解决此问题,洗脱时使用低 pH 的缓冲液。此外,一些噬菌体还能与用于淘洗的细胞悬液中的死细胞和细胞碎片非特异性结合。为了减少这种非特异性 binder 的富集,需要确保筛选时所用的细胞是高活率的。
3、通过脂质体、纳米盘和 VLPs 展示抗原
膜蛋白也可以展示在两亲结构上,如脂质体、纳米盘和病毒样颗粒(VPLs)(图 1c)。脂质体是一种球形囊泡,由一个或多个磷脂双分子层膜(通常由磷脂分子组成)所包围的一定体积的水溶液组成。磷脂双分子层膜模拟了质膜的环境,为展示膜蛋白提供了一个合适的平台。在脂质体上展示的抗原需要形成脂质体,从原生膜环境中提取抗原(无论是从天然来源分离还是重组表达),最后将提取的抗原转移到预形成的脂质体上。当重组表达时,抗原需要与标签融合,以便后期纯化。
膜蛋白还可以展示在纳米盘上,是纳米大小的圆盘结构,由两条两亲的螺旋蛋白带(膜结构蛋白,即 MSPs)包围的磷脂双分子层组成。纯化的膜蛋白可与磷脂和 MSPs 混合以获得携带膜蛋白的纳米盘(图 1c)。蛋白带限制了双分子层的大小,因此与脂质体相比,纳米盘的大小分布更加单分散和一致。此外,纳米盘为膜蛋白提供了更稳定的环境,与脂质体相比可以保存更长时间。此外,由于其盘状结构,加入纳米盘中的蛋白质可从膜的两侧接触到。这在需要接触膜蛋白的细胞外和细胞内结构域时非常有利。脂质体和纳米盘都可用于展示离子通道和多次跨膜蛋白,如离子通道和 G 蛋白偶联受体,这些蛋白直到最近才被证明难以表达/纯化。然而,脂质体和纳米盘都依赖去垢剂提取膜蛋白,这会改变蛋白质的结构。作为一种无去垢剂的替代方法,使用苯乙烯马来酸(SMA)共聚物可将膜溶解到脂质纳米盘中,这种纳米盘是由 SMA 共聚物环绕的磷脂双分子层组成的纳米大小的盘状结构,其结构被称为 "苯乙烯马来酸-脂质颗粒"(SMALP)。使用无去垢剂提取的蛋白也能融入脂质体用于抗原展示。
细胞毒性蛋白过表达时可以引起宿主细胞的生长延迟和毒性,使该蛋白难以表达。细胞毒性蛋白和膜蛋白可以在无细胞的情况下进行合成,合成反应包括改良的细胞裂解液,它为目标蛋白的表达提供了合适的环境,可能与模拟结构(如脂质体和纳米盘)相结合,从而捕获并展示新合成的蛋白。膜蛋白在纳米盘上的展示已经在噬菌体展示中应用。
VLPs 是另一种适于噬菌体展示的膜蛋白的展示方法。VLPs 是非感染性的、类似病毒的多蛋白结构,它没有病毒的基因组,但含有病毒的衣壳蛋白。目标膜蛋白可以瞬转入表达衣壳蛋白的宿主细胞中,并在其表面过表达。自组装的病毒衣壳蛋白引导质膜出芽,从而形成缀满目标抗原的 VLPs(图 1c)。可以先合成 VLPs 随后将目标蛋白共价结合在其表面上。与脂质体相比,VLPs 更为稳定,能以更高的密度呈现抗原。不过,VLPs 的成本也很高,因为商业化的 VLPs 价格昂贵,而且在实验室中生产 VLPs也很费力。
先进的噬菌体展示筛选策略
利用噬菌体展示筛选进行抗体发现活动可以采用多种策略和方案。这些策略应经过仔细挑选,以最大限度地提高发现具有所需特征的抗体的机会。在这里,我们将介绍可用于发现具有结合特性(如交叉反应、高选择性或 pH 依赖性)的抗体的不同策略。
1、负筛策略:抗原标签和载体材料
在筛选过程中,针对所有抗原(包括标签或融合伙伴)以及支持基质(如链霉亲和素磁珠)的 binders 都有可能被筛选出来。为了克服这一问题,通常会使用非目标物进行负筛,以限制针对目标物以外抗原的抗体的富集。例如,使用链霉亲和素磁珠对生物素化蛋白进行选择之前,可以先将文库暴露在与链霉亲和素磁珠偶联的生物素化的非目标蛋白质上,以减少进入预期目标筛选步骤的这类不需要的 binder 的比例(图 2a)。
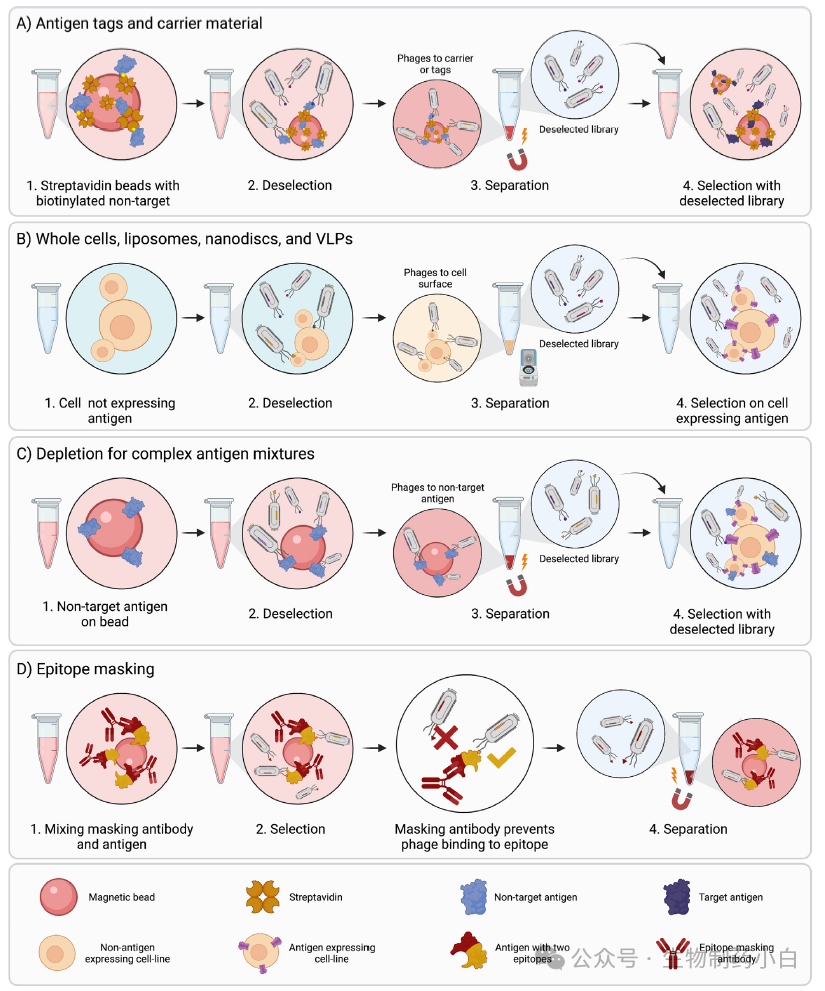
图2
2、负筛策略:全细胞、脂质体、纳米盘和 VLPs
同样的原理可应用于更复杂的靶标,如全细胞、脂质体、纳米盘或 VLPs。在对全细胞进行淘选时,可使用转染细胞的方法来表达需要展示的抗原,如感兴趣的表面受体,然后使用模拟转染的细胞或未转染的细胞来进行负筛,富集受体特异性的抗体。此外,在发现针对病毒靶标的抗体时,可以使用感染的宿主细胞作为抗原进行筛选,未感染的宿主细胞裂解液用于。对于脂负筛。使用内源性表达目标蛋白的细胞时,最理想的是,使用敲除目标抗原的相同细胞进行负筛(图2b)。对于脂质体、纳米盘和 VLPs 来讲,也可采用类似策略,即在抗原展示颗粒上进行筛选之前,先使用未嵌入抗原的展示颗粒进行负筛。
更为复杂的情况是,在使用哺乳动物或细菌细胞的表型发现活动中,在事先不知道靶标的情况下使用整个细胞进行筛选。在这种情况下,可以在与靶细胞相似的非靶细胞上进行负筛,以避免针对常见细胞表面抗原的富集。然而,像转染细胞那样的完美匹配是不可能的。例子包括,目标是发现靶向 B细胞上的抗体,使用 T 细胞进行负筛。
3、负筛策略:复杂抗原混合物的去除
通过去除进行的负筛可用于复杂靶标,如全细胞或不纯蛋白质样本,也可用于靶标未知的情况。例如,在事先不知道靶点的情况下对全细胞进行筛选。在这种情况下,尽管靶抗原是未知的,但非靶抗原可能是已知的,这样就可以进行蛋白去除筛选。在蛋白质去除过程中,噬菌体展示文库与包被或捕获在免疫试管或磁珠上的非目标抗原对应的重组蛋白质一起孵育。之后,未结合的噬菌体被转移到目标抗原上,并用于选择。
4、负筛策略:表位特异性去除
对于治疗性抗体来说,抗体与目标抗原的哪个表位结合往往至关重要,因为这可以决定抗体是否具有治疗价值。为了引导抗体与抗原的特定部分结合,可以采用不同的技术。为了找到受体的配体结合位点结合的 binders,可以通过加入高浓度配体来进行洗脱,这样只能洗脱出与配体竞争结合的抗体。然而,这种方法最大的弊端是主要是低亲和力抗体被洗脱下来,需要使用特异性的减少低亲和力 binders 量的方法。抗体阻断(Antibody blocking)也称表位掩蔽(epitope masking)是另一种发现针对抗原特定部分抗体的策略。在筛选过程中,先前发现的与抗原非目的表位结合的抗体也会被纳入阻断范围。这些抗体会结合并阻断抗原的某些表位,使噬菌体上的新抗体在筛选步骤中无法接触到某些表位。这样,结合新表位的抗体就能得到富集(图 2d)。除抗体外,受体-配体复合物也能以类似的方式去除那些与受体或配体一样不识别位点相同位点的 binders。
5、竞争筛选
在许多情况下,希望减少与靶抗原相关抗原的结合力。因此,目标是将筛选集中在目标抗原独有的表位上,减少与相关抗原共有表位的结合比例。然而,负筛并非百分之百有效,这与靶标浓度和与共享表位结合的亲和力有关。抗体与抗原的结合是一种遵循质量作用定律的平衡反应。因此,并非所有抗体都能在特定时间点与抗原结合。因此,在所有的负筛策略中,有几种抗体对用于负筛的抗原是具有特异性,但在负筛结束的时间点,这些抗体不会与抗原结合。因此,这些对用于的负筛抗原具有特异性的抗体将被带到筛选阶段,并可能在此与目标抗原结合。为了避免这种情况,可以在存在竞争抗原的情况下进行筛选(竞争筛选),作为负筛的替代方法(或与负筛相结合)。
在竞争筛选中,目标抗原和非目标抗原与抗体库混合,使抗体在目标抗原和非目标抗原之间竞争结合。使用大量过量的非目标抗原会促使抗体与目标抗原和非目标抗原共有的表位结合,从而提高回收抗体中与目标特异性表位结合的抗体比例。因此,在筛选步骤之后,与目标抗原结合的抗体会被富集。用结合抗体收集靶标的策略包括用生物素等标记靶标,而不标记非靶标(图 3a)。这种方法可用于全细胞和纯化的蛋白。另一种方法是以不同方式呈现靶抗原和非靶抗原,如将靶抗原固定或包被在塑料表面,然后在溶液中加入非靶抗原(图 3b)。对于全细胞筛选来讲,非目标细胞也可作为膜颗粒呈现,从而产生不同密度的目标抗原和非目标抗原,这样就可以通过离心进行分离。
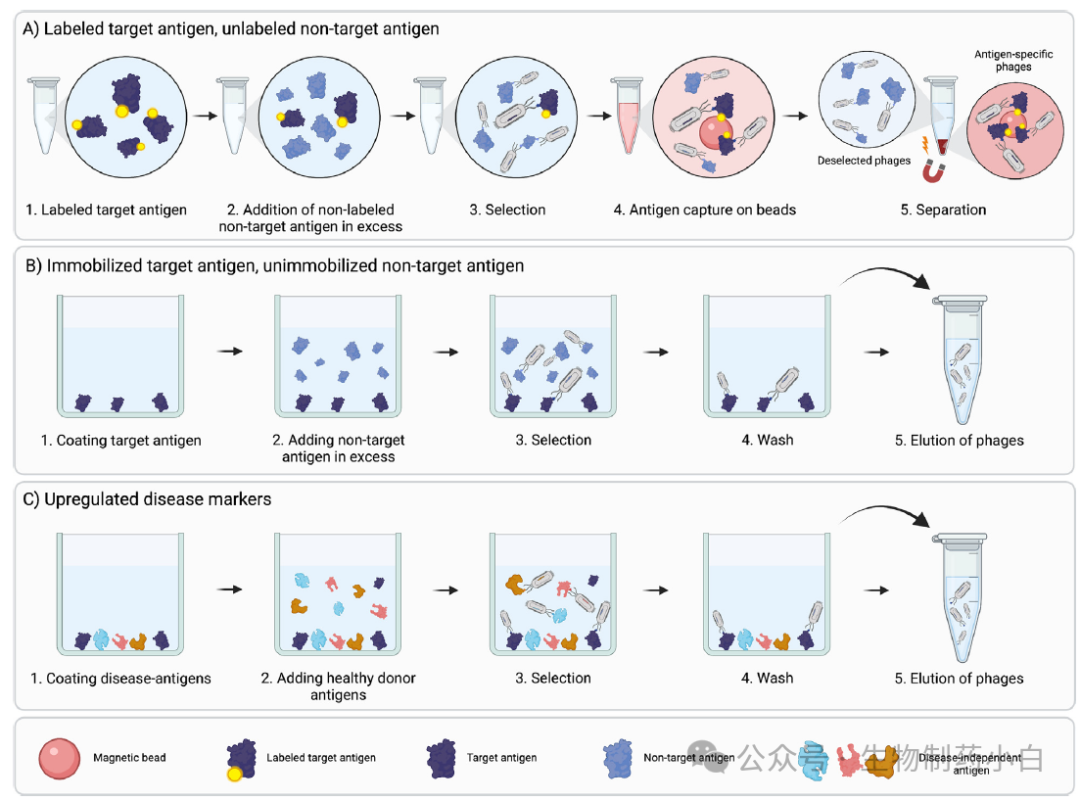
图3
与健康样本相比,病变组织、细胞和体液中的抗原上调通常是治疗或诊断的相关靶点。另一种发现这些靶点和靶向上述靶点的抗体的方法是利用表型筛选。然而,在这种情况下,使用健康样本的经典负筛策略并不理想,因为,在负筛步骤中(健康样本表面),所有抗原的 binders 都会减少。相反,在筛选期间包含竞争筛选可以发现这些上调靶点的抗体,不仅仅是那些特异性表达的靶点。通过改变用于竞争的非靶标抗原的添加量,这些筛选可以帮助发现针对上调到一定程度的靶标的抗体。抗体将与展示在目标抗原和非目标抗原上的抗原竞争结合,表达水平将决定抗体是主要被富集还是被清除(图 3c)。
产生交叉反应抗体的策略
抗体是高度特异性的分子,筛选通常是为了找到特异的抗体,使其结合一种目标抗原,避免与其他分子结合。然而,在许多情况下,尽管抗体必须对目标具有高度特异性,但它们也倾向于结合同一靶标的同源物或不同突变版本。例如,如果能识别该抗原的小鼠和猴的同种抗原,那么同时与人源靶点结合的治疗抗体的临床前研究就会更容易进行。另一个例子是,感染性疾病和抗蛇毒素的开发,识别不同病毒、细菌或毒素的广泛性中和抗体被发现就更有益。
1、交叉淘选
实现交叉反应的一种方法是进行交叉淘选,这种方法可以在筛选过程的不同轮次钟改变抗原(图 4a)。这种技术已被用于寻找针对艾滋病毒、流感病毒 A 株以及多种物种的蛇毒细胞毒的保守表位的抗体。成功与否取决于相关靶标之间的保守程度。对保守程度低的同源物或类似物需要广泛的交叉反应,可能会导致找到低亲和力的抗体、非特异性结合抗体或无抗体。
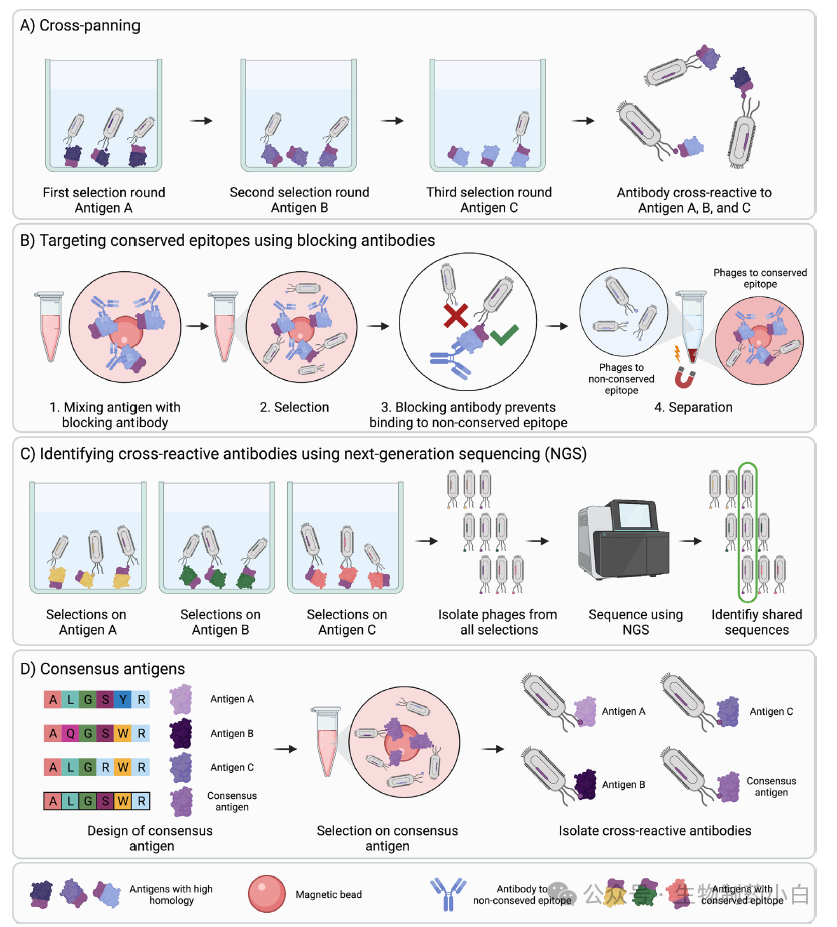
图4
2、抗体阻断和下一代测序
当同一抗原被用于重复淘选时,为了发现交叉反应抗体,可利用上文所述的抗体阻断法引导淘选指向抗原的保守表位(图 4b)。另一种方法是利用下一代测序技术(NGS)评估非同源蛋白平行筛选时的产出,以鉴定所有产出池中富集和发现的抗体(图 4c)。这种方法用于发现结合血清白蛋白的 binders。
3、共同抗原
鉴别交叉反应抗体的另一种方法是在筛选中使用共同抗原(图 4d)。共同抗原的设计方法是对多个同源抗原进行序列整合,并构建一个 "平均 "的共同抗原,在每个位点使用最常见的氨基酸。在有多个氨基酸选择存在的位点上,可以采用不同的方法,例如基于相似的化学特性或筛选氨基酸,或选择具有最佳预测免疫原性的氨基酸。利用共同毒素对马进行免疫,成功地产生了针对不同蛇的短神经毒素的多克隆广谱中和抗体,并推测使用共识抗原可能会在基于噬菌体展示的抗体发现活动中非常有用。
4、筛选环境敏感的抗体
在注射治疗抗体时,抗体在被细胞内吞前一直处于循环状态。内吞后,抗体被引导至溶酶体,在那里它们可以被再次释放至循环中,因为与新生儿受体(FcRn)结合。然而,当抗体与抗原结合时,抗原-抗体复合物被内化,要么在溶酶体内降解,要么被再次投入循环。为了避免抗原或者不需要的抗体碎片循环,可以将抗体改构成在酸性内体中从抗原上释放,当抗体进入循环时抗原则被降解(图5a)。对于治疗性抗体来讲,这样改构可以降低药物的给药剂量或者给药频率。鉴于血液循环(pH7.4)和内含体(pH5.8))的 pH 不同,我们需要的是在不同 pH 对抗原有不同亲和力的抗体,这样抗体就会在非载模式下进入循环。与传统抗体相比,使用 pH 依赖的抗体可降低血浆中的抗原浓度,该抗体还可以被设计为 FcRn 亲和力增加版本的抗体。此外,pH 依赖的结合可增强抗体药物偶联物的细胞毒性,并可能促进抗体穿过血脑屏障。为发现依赖 pH 的抗体,可对噬菌体筛选步骤进行修改,以丰富这一特性。在筛选过程中,中性 pH 值时产生结合,随后将 pH 降至 5.4,使得依赖 pH 值的结合体被洗脱。使用富含组氨酸的文库可以提高发现 pH 依赖的 binder 的机会,文章后续会详细说明。
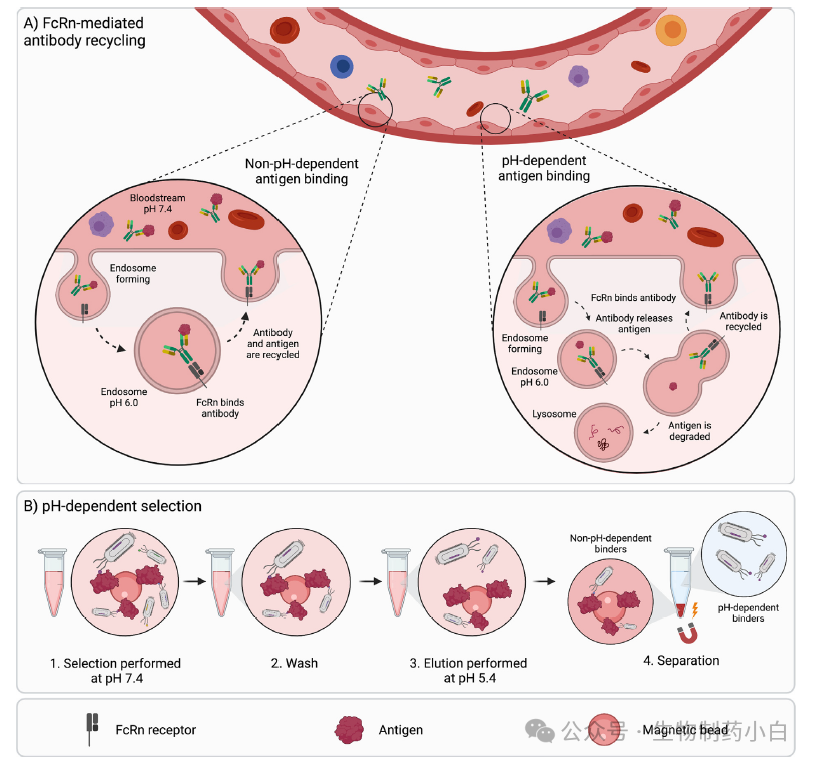
图5
提高抗体半衰期的另一个策略是使抗体的结合依赖于离子的存在。在内涵体和血浆中,钙离子的浓度存在差异。因此,在同样 pH 依赖的条件下,钙离子依赖可以被用于将抗体从内体中循环出来。例如,在含钙缓冲液中筛选 IL-6R,然后加入 EDTA 来螯合 Ca2+,从而将钙依赖性抗体洗脱下来,结果发现了一种能加速清除血浆中抗原的抗体。
根据抗体的最终用途,可在筛选过程中附加额外要求,如提高稳定性或减慢清除率。一种增加稳定性的方法是增加温度或者在筛选过程中增加蛋白酶,用以富集在上述条件下稳定的抗体。在发现慢速解离抗体时,通常会在连续的筛选步骤中降低抗原浓度,并添加额外的洗涤步骤。
体内噬菌体展示筛选
如前所述,使用全细胞作为抗原进行噬菌体展示筛选是一种有效的策略,它能兼顾抗原的正确折叠、翻译后修饰和功能性等诸多方面。然而,活体生物体内抗原的复杂性和药理学仍是空白。由于组织微环境的变化,相似的细胞类型可能会有完全不同的表达谱或翻译后修饰,无论是在健康组织还是在患病组织。
为了完全模拟抗原的体内图谱,开发了体内噬菌体展示技术。噬菌体展示库通常是静脉注射并让其循环,然后进行心内灌注,清除未结合的噬菌体。最后,将噬菌体从收获的匀浆或裂解的靶组织中释放出来,并进行测序分析。如果感兴趣的靶点是已知的,则可在测序前分析抗体与靶点的结合情况。通过比较目标组织中存在的序列与输入组织或无关组织中存在的序列,确定噬菌体的富集程度,并选择富集序列作进一步鉴定(图 6)。
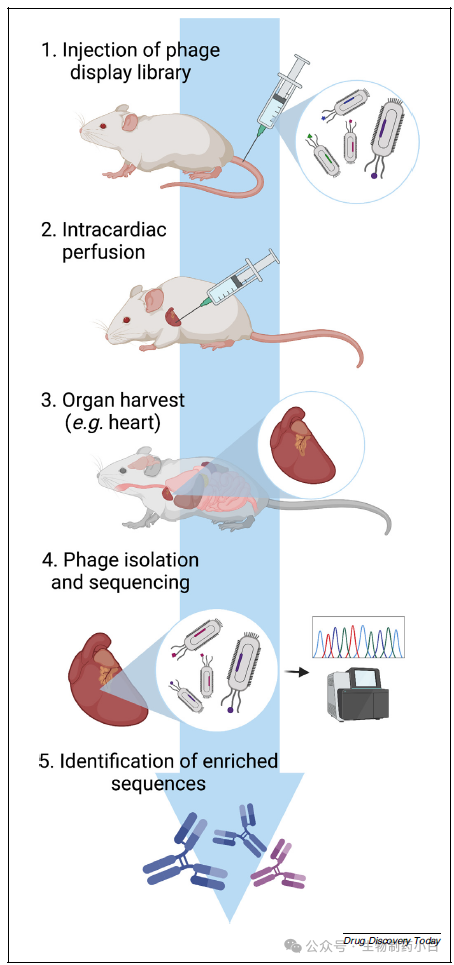
图6
在描述体内噬菌体展示筛选的原始文献中,基于肽的噬菌体展示文库被用于确定与脑或肾血管特异性结合的肽。利用这种技术还发现了 scFvs 和单域抗体(sdAbs)形式的抗体。体内噬菌体展示主要在小鼠或大鼠身上进行,但也有少数研究描述了该技术在人身上的应用。然而,在人身上不可能进行心内灌注,因为这会导致受试者死亡。为了指定特异性靶向目的组织的序列,需要对血液中的噬菌体进行分析和比较。
抗体噬菌体展示文库的设计
如上所述,可根据所需抗体的最终要求,采用不同的筛选策略进行选择。除了所使用的筛选方法外,还可以使用各种噬菌体展示文库来优化获得具有所需特征的抗体的机会。文库可以基于不同的抗体形式、天然的或合成的抗体序列,甚至可以定制为具有特定生物物理或结合特性的抗体。在文库构建过程中,可以采用不同的克隆策略,如轻链和重链序列的连续克隆、重叠延伸 PCR 剪接或金门克隆来连接 VH 和 VL。在此,我们将介绍一些常规文库类型以及更先进的定制文库设计。
根据构建文库所用抗体序列的来源,抗体噬菌体展示文库总体上可分为两大类:天然文库和合成文库。直接从 B 细胞或利用从头合成技术合成获得序列。
1、天然文库
天然文库捕捉供体的抗体库,可以来自特异性免疫或非免疫("天然")供体。抗原挑战后的免疫反应伴随着抗体从幼稚 IgM 到分泌型 IgG 的类别转换。因此,天然抗体库通常从健康供体的 IgM 库中产生,以捕获多样化的抗体群。相比之下,反映供体近期免疫




