本文来源于:生物制品圈 本文原创为:干细胞者说
类器官技术始于2009年,荷兰Hubrecht研究所的 Hans Clevers 团队成功的将成体干细胞培养成为小肠的隐窝和绒毛结构。
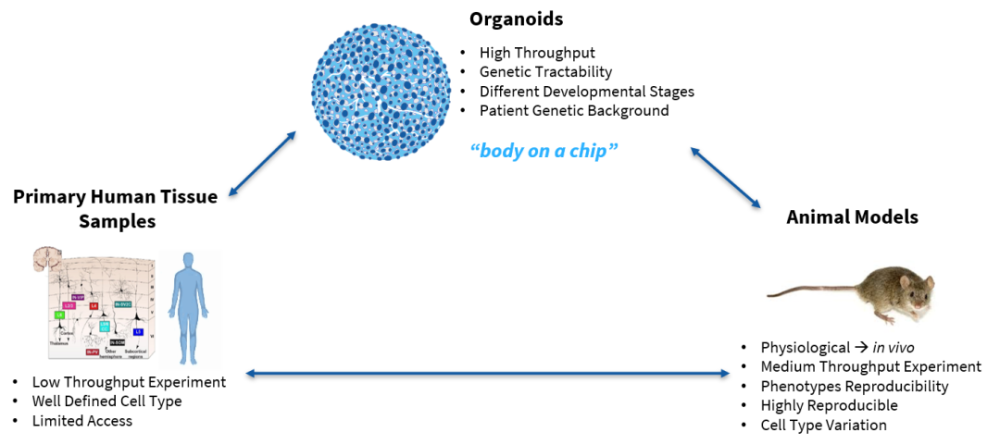
类器官 VS 组织样本 VS 动物模型
● ● ●
目 录
一、类器官的概念
二、类器官的发展历史
三、类器官的培养
四、类器官的应用
五、类器官的产业链
六、类器官的市场格局
七、类器官的挑战
八、类器官的未来发展
-01-
类器官的概念
类器官(Organoids)指利用成体干细胞或多能干细胞进行体外三维(3D)培养而形成的具有一定空间结构的组织类似物。尽管类器官并不是真正意义上的人体器官,但能在结构和功能上模拟真实器官,能够最大程度地模拟体内组织结构及功能并能够长期稳定传代培养。
目前类器官分为两类:组织来源类器官和多能干细胞来源类器官。
相比传统的二维培养模型,类器官代表着一种能够概括整个生物体生理过程的创新技术,具有更接近生理细胞组成和行为、更稳定的基因组、更适合于生物转染和高通量筛选等优势。而与动物模型相比,类器官模型的操作更简单,还能用于研究疾病发生和发展等机理,因而在器官发育、精准医疗、再生医学、药物筛选、基因编辑、疾病建模等领域都有广泛的应用前景。2013年,类器官被《科学》杂志评为年度十大技术。2018年初,类器官被评《自然·方法》评为2017年度方法。
在Pubmed上搜索 “类器官” 这一词条,类器官相关文章从2010年的42篇,在短短十年间,跃升到2020年的2097篇。类器官以极迅猛的态势成为研究热点。
-02-
类器官的发展历史
类器官的起源可以追溯到1907年,当时44岁的美国贝克罗莱那大学教授威尔逊 (H. V. Wilson)发现通过机械分离的海绵 (sponge) 细胞可以重新聚集并自组织成为新的具有正常功能的海绵有机体,他的研究结果于1910年发表。威尔逊的研究证明了成年的有机体在无需外界帮助、无需从特定的解剖学阶段开始,也具有完整的信息并可以成功发育成新的有机体。
对类器官技术而言,另外一个十分关键的契机是干细胞技术的发展。干细胞想必大家并不陌生,很多人对于干细胞的第一印象都是来源于媒体中对于血液疾病造血干细胞移植疗法的介绍。近年来火热的干细胞研究,主要开始于上世纪末。1987年,A. J. Friedenstein发现间充质干细胞 (Mesenchymal Stem Cell, MSCs)。 1998年,美国生物学家James Thomson首次分离得到人胚胎干细胞。2007年,山中伸弥教授成功制造出人诱导多能干细胞(induced Pluripotent Stem Cells, iPSC)。如今,绝大多数类型的非肿瘤来源的人源类器官均可由MSCs或iPSC发育而来,干细胞研究的飞速进展为类器官研究带来新的活力。
类器官发展主要事件
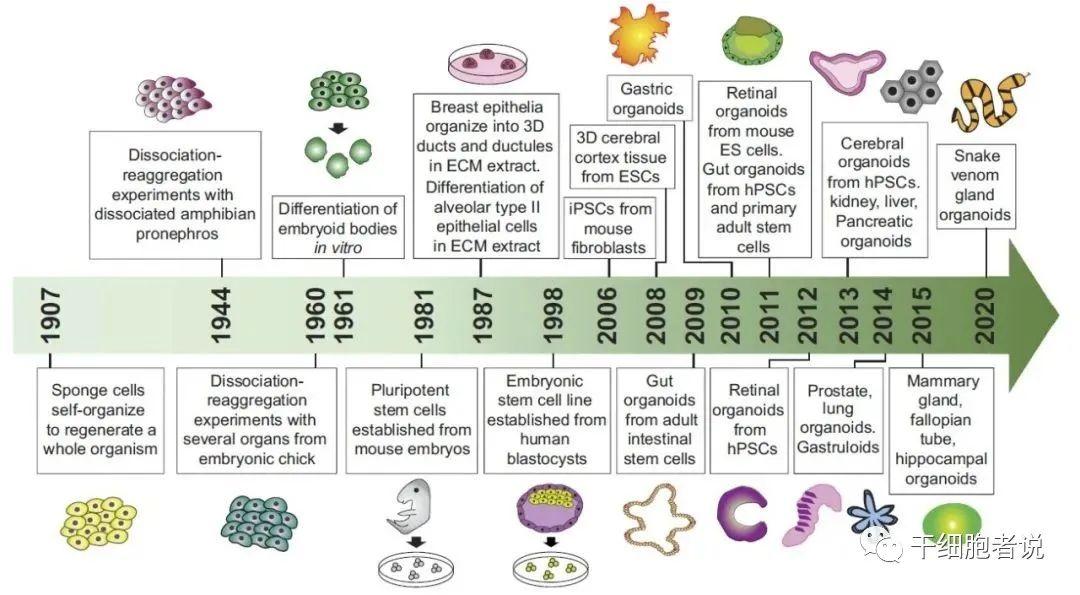
数据来源:Am J Physiol Cell Physiol杂志
当代类器官的发展成果,主要集中在近十余年。
- 2007年,Hans Clevers 的实验室通过 lineage tracing 验发现小肠和结肠的干细胞为 Lgr5+细胞。
- 2009年,Hans Clevers实验室使用单个鼠LGR5+肠干细胞在体外自组织成为具有肠隐窝-绒毛结构的肠类器官。
- 2011年,由人多能干细胞和原代成体干细胞发育而来的肠类器官被成功制作。同年,由鼠胚胎干细胞培育而来的视网膜类器官被首次成功培育。
- 2012年,由人多能干细胞发育而来的视网膜类器官成功培育。
- 2013年,由人多能干细胞发育而来的脑类器官被成功培育。肝、肾、胰类器官被成功培育。
- 2014年,前列腺、肺类器官被成功培育。
- 2015年,乳腺、输卵管、海马体类器官被成功培育。
- 2020年,蛇毒液腺类器官被成功培育。
类器官的研究热点是病人来源的类器官 (Patient-Derived Organoids, PDOs),因为通常用于肿瘤患者的疾病建模、研究与药物筛选,常常被称为肿瘤类器官。肿瘤类器官的发展开始于2013年,自此之后呈逐年上升趋势。肿瘤类器官是指将患者活检、穿刺或手术切除组织在基质胶中培养数周得到的类器官。肿瘤类器官在高度保持源肿瘤的异质性和患者之间的异质性的同时,类器官个体间形态、尺度保持基本均一,为肿瘤发病机理研究、药物筛选、个性化精准医疗、再生医学等领域提供了快速、优良的技术平台。
目前3D类器官培养技术已经成功培养出大量具有部分关键生理结构和功能的类组织器官,比如:肾、肝、肺、肠、脑、前列腺、胰腺和视网膜等。
-03-
类器官的培养
类器官的培养可以利用体细胞、成体干细胞(包括祖细胞)或多能干细胞。2009年,肠道器官模拟技术率先取得突破,研究人员发现,成人肠道干细胞可以在体外增殖和自发组织化。其特征是能够表达LGR5,这是一种编码Wnt激动剂R-spondin受体的基因,同时需要特定的分子围绕在旁(如Wnt、KGF和noggin)。以此为理论基础,研究人员开发了一种三维培养体系,能够在体外重建肠道干细胞的适宜环境,并从肠道上皮细胞或单个LGR5+干细胞分化出具有自我更新能力、保持肠道腺窝绒毛状结构的类器官。该模型可以持续扩增达3个月,稳定的基因组保证了纯化和生产放大等优势,此后这种方法被用于从其它主要器官上皮组织培养各种类器官。
成人干细胞衍生的类器官培养,通常是通过将分离的成人干细胞或所需器官培养的单细胞悬浮液,嵌入到细胞外基质(ECM)水凝胶中来建立的。例如肠道器官,从小肠或结肠分离出的隐窝细胞足以培养出类器官,也可以从分离的成人肠干细胞中培养出类器官。
上皮类器官培养基是以附加与器官相关的生长因子的培养基为基础的。因此,从其他组织(如呼吸道、肝脏、胰腺、皮肤、膀胱、大脑、心脏)提取的细胞器要求在培养中补充相关生长因子。例如大脑类器官培养过程如下图:诱导多能干细胞(iPSC)衍生细胞在神经诱导介质中生长,产生神经外胚层,嵌入Matrigel中,并在旋转生物反应器或轨道摇床中生长,以更好地扩散,获得三维脑器官。在暴露于维甲酸的情况下,大脑器官通过自我组装模式,形成自缔和组织,形成包括放射状胶质细胞在内的不同种群的神经祖细胞,这些神经祖细胞扩展形成大脑结构。
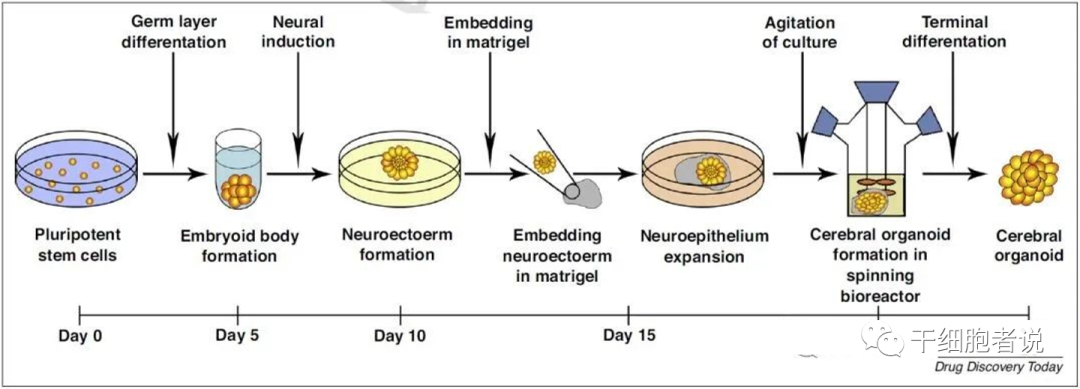
除了成体干细胞,多能干细胞(包括诱导干细胞和胚胎干细胞)也可以利用其自我更新及分化能力来制备类器官。由于从多能干细胞中提取的类器官是通过同质群体定向分化而形成的,因此,必须在一个唤醒胚胎发生的动态过程中重新创造组织特异性细胞类型及其微环境。因此,多能干细胞类器官培养必须在分化过程中提供合适的生态位信号。由于这一过程较复杂,多能干细胞类器官往往含有不同于模型器官的细胞类型,使靶组织的信号环境和自组织复杂化。
1、科学研究中的类器官培养
1.1 上皮类器官研究上皮细胞-免疫细胞相互作用
上皮细胞出现在机体所有和外界接触的边界,比如皮肤,呼吸道,肺,消化道,是机体对抗病原体侵染的第一层屏障,也是第一个对病原性感染作出反应的细胞。为了维持体内平衡,并提供对感染的快速反应,上皮细胞与免疫细胞密切配合。所以在上皮区域,也是全身免疫细胞浓度最高的区域。建立上皮细胞和免疫细胞相互作用的模型,是研究抗感染免疫和损伤后免疫的重要手段。上皮细胞类器官的建立,可以非常精准的模拟机体上皮环境,也被发展起来研究上皮和免疫细胞相互作用。
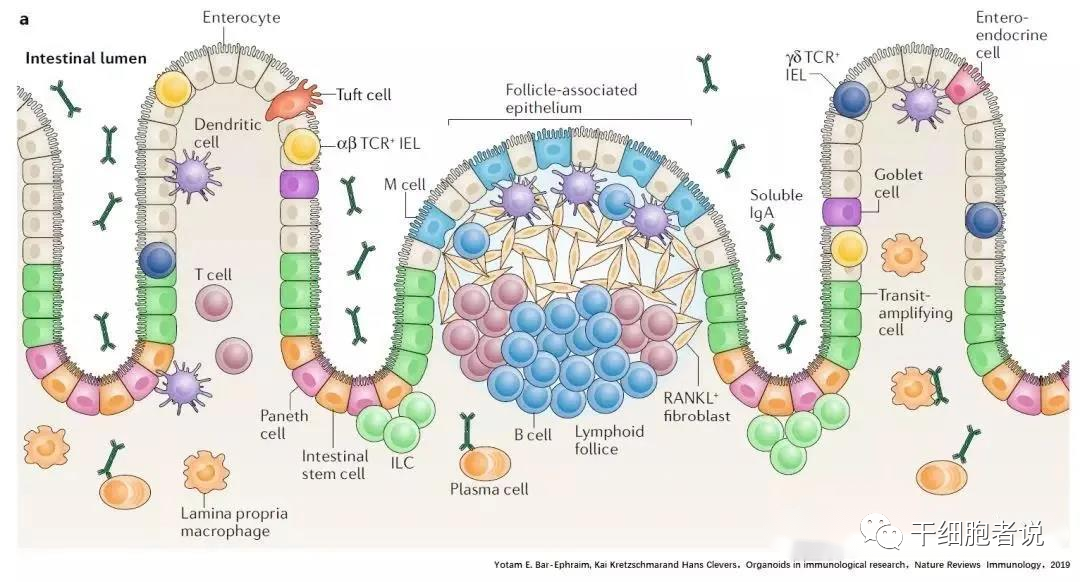
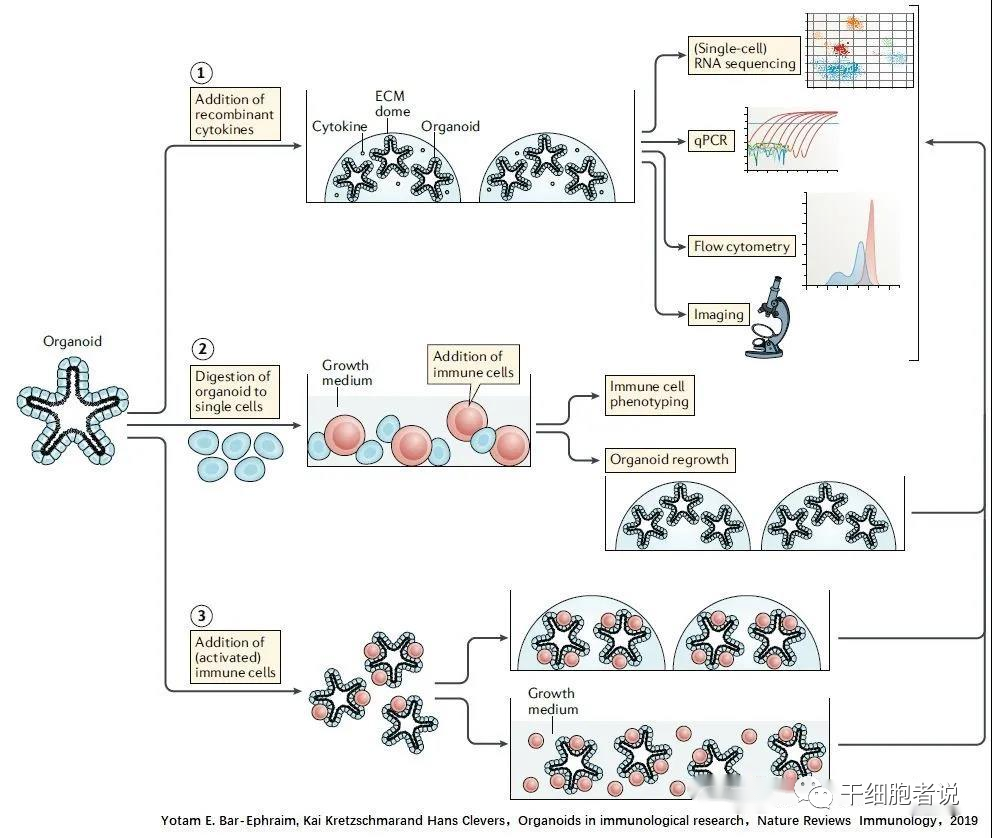
有三种共培养的模式
1.用存在于细胞外基质中的重组细胞因子处理类器官,评价免疫细胞衍生细胞因子对于上皮细胞的影响。如IL-4和IL-13促进丛生细胞分化,而IL-22支持干细胞增殖和存活。
2.将器官消化到单个细胞,然后在免疫细胞存在的情况下,再生长。用于评估免疫细胞和免疫细胞衍生的细胞因子(可溶性或膜结合)对器官生长和分化的影响,以及上皮细胞对免疫细胞表型的影响。
3.在ECM或生长培养基(悬浮培养)中,向完整的类器官中添加(活化的)免疫细胞,如T细胞或固有淋巴样细胞(ILCs),以评估免疫细胞与上皮细胞之间的相互作用。这些检测的读数通常包含消化形成的器官和随后的转录。单细胞RNA测序或定量PCR(QPCR),成像和/或流式细胞术评估上皮细胞和/或免疫细胞表型。在这些共培养中使用的免疫细胞要么直接从小鼠组织(例如,脾细胞、肠上皮内淋巴细胞、固有层T细胞、固有层ILCs或肺ILC2s)中分类,要么直接从人外周血中提取,要么先在体外分化。
1.2 胸腺类器官研究T细胞发育
胸腺是T细胞成熟和从祖细胞向成熟的幼稚淋巴细胞分化的中心部位。来源于骨髓的T细胞祖细胞在胸腺皮质进行阳性选择,随后在胸腺髓质中进行阴性选择。胸腺的这些区域由两种不同的上皮细胞组成:皮质胸腺上皮细胞(CTECs)和髓质胸腺上皮细胞(MTECs)。3D重建胸腺被证明是模拟其功能的关键,几种胸腺类器官的产生方法:这些器官培养通常是从人类身上建立起来的或胎鼠或新生儿胸腺组织,但也有报道称TEC样细胞与人胚胎干细胞的体外分化,这些培养都产生胸腺样结构。在体外产生活的T细胞,并在移植到裸鼠上时发挥作用。有趣的是,虽然长时间的类似胸腺的培养是可能的(离体培养长达56天),但细胞在连续传代时失去了集落形成能力。重要的是,虽然在成年小鼠中已经发现了一种双能的TEC前体,但含cTECs和mTECs的胸腺器官尚未从单个干细胞中生成。此外,考虑到小鼠体内某些双能TEC前体的生长因子已被发现(例如BMP 4和IL-22),可以尝试这些因子是否可用于维持TEC的祖细胞来源的类器官。
2、肿瘤微环境
两种主要的方式被使用(以非小细胞肺癌为例)
在整体方法(左)中,肿瘤活检组织是在气液界面间环境培养,所有肿瘤细胞类型的细胞悬液,包括内源性免疫细胞和其他非上皮细胞类型,促进肿瘤特异性T细胞的生长。
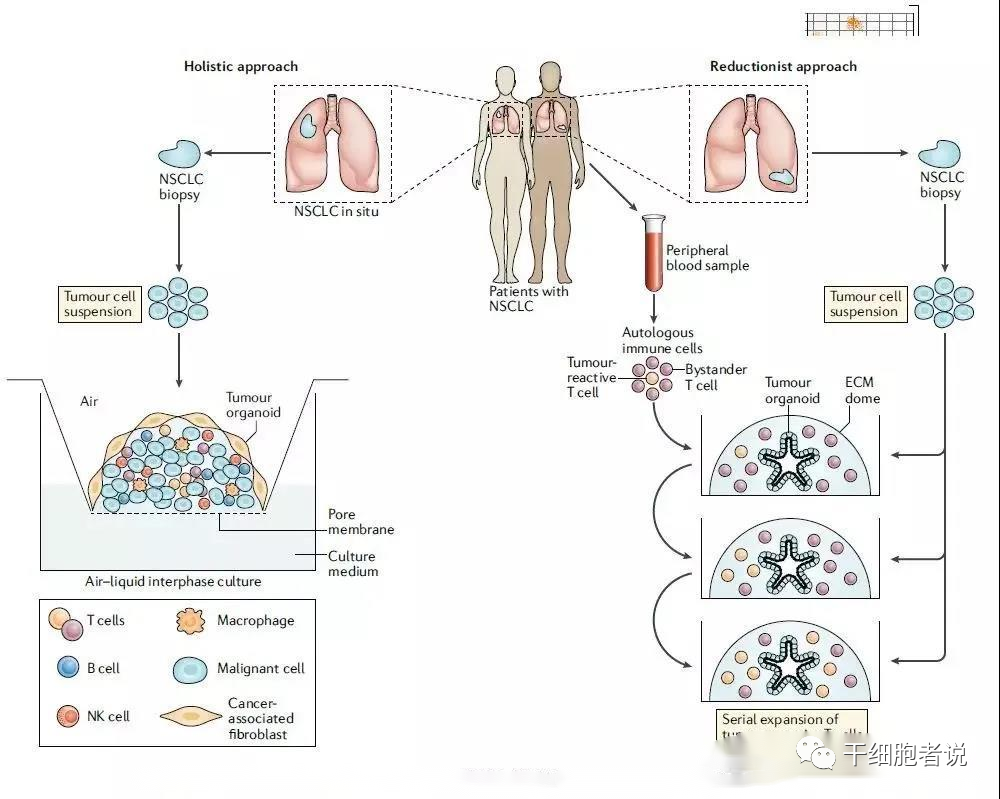
在还原模拟方法(右)中,上皮类器官是从肿瘤活检组织中生长出来的,然后与来自同一患者外周血的自体免疫细胞共培养,以促进肿瘤反应细胞的连续扩张。
虽然整体方法允许包括整个肿瘤微环境的肿瘤材料的培养,因此与体内情况非常相似,但不易长时间维持,而还原模拟方法允许肿瘤上皮的长期培养和扩展,这使得更广泛,更长期的研究成为可能。
3、药物筛选
3.1 促进心肌纤维细胞生长化合物筛选
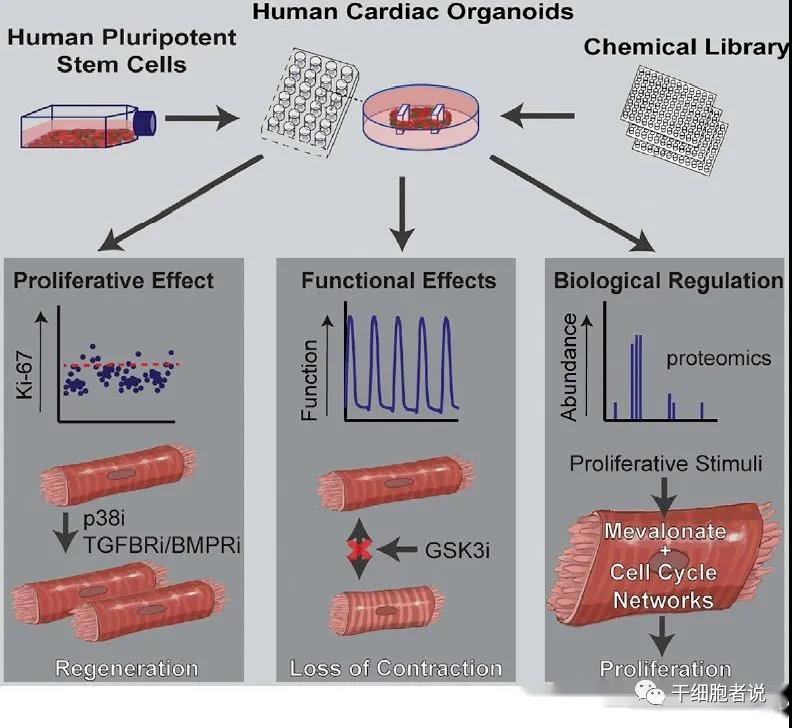
动物模型,主要是老鼠,被广泛用于研究心脏病,提供有价值的结果。然而,由于许多功能和生物学特性的物种差异很大,它们对人类心脏疾病和药物安全性的推断很差。人类多能干细胞(hPSC)可以为生物医学和药物研究提供无限的人类心肌细胞来源,有可能弥合这一鸿沟。然而,传统2D培养中的hPSC源性心肌细胞缺乏功能成熟,,这在某些情况下阻碍了它们准确预测人类生物学和病理生理学的能力。多细胞3D人体类器官提供了更精确的模型,是解决这一问题的潜在方法。澳大利亚昆士兰大学生物医学系的科学家在Cell Stem Cell发表文章,阐述他们基于96孔板,培养心脏心肌类器官,进而进行化合物筛选的新流程。
具体流程如下图:
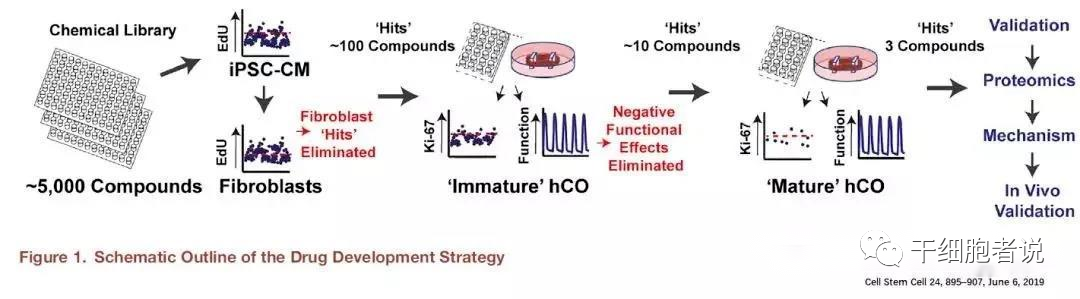
基于类器官,将5000种化合物,筛选出不同功能化合物。
3.2 特定神经类器官培养及药物筛选等应用
首先神经球在不同分化培养基种培养(具体的诱导因子及生长因子见下图),产生大脑,中脑,海马,前脑等不同脑部类器官。
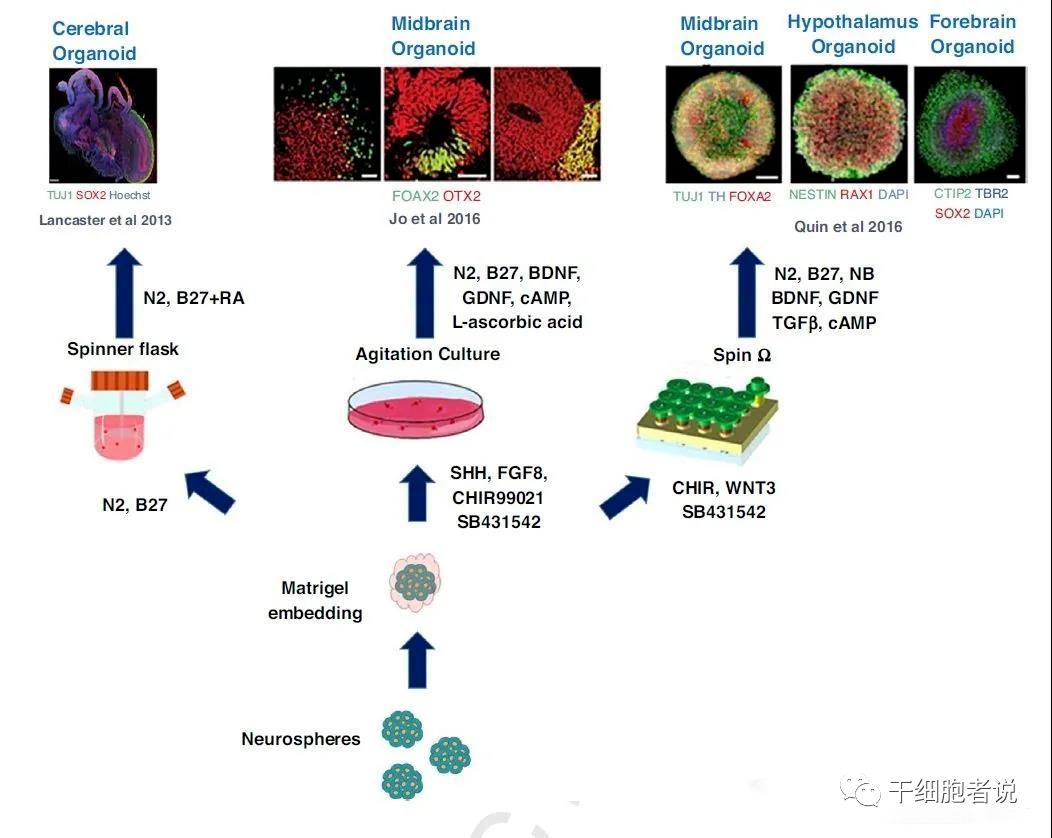
(资料来源:干细胞者说)
-04-




