文章来源:生物屋,作者:屋中人
[细胞因子概述]
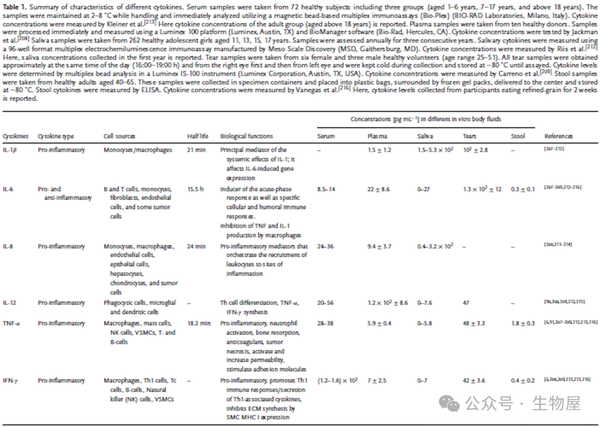
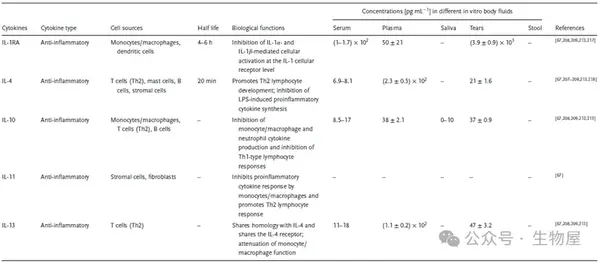
根据其作用,细胞因子也可分为促炎性或抗炎性,促炎细胞因子包括IL-1、IL-6、IL-8、IL-11、IL-12、TNF-α、IFN-γ和 TGF-β等,促进炎症反应并倾向于刺激免疫活性细胞。相反,抗炎细胞因子,如 IL-4、IL-6、IL-10、IL-11、IL-13、IL-1受体拮抗剂 (IL-1RA)和 TGF-β,可抑制炎症并抑制免疫细胞。一些细胞因子(例如 IL-6、IL-11、TGF-β)具有促炎和抗炎特性。
·单一细胞因子可能由不同细胞分泌,并且根据具体情况具有促炎或抗炎活性,从而产生多种免疫反应。促炎细胞因子和抗炎细胞因子之间动态且不断变化的平衡通过介导和调节炎症在宿主免疫系统中发挥着重要作用,促炎性细胞因子有助于自身免疫性炎症的引发和传播,而抗炎性细胞因子则有助于炎症的消退和自身免疫性疾病急性期的恢复。
考虑到先天免疫和适应性免疫,促炎和抗炎细胞因子对免疫细胞分化、炎症、血管生成、肿瘤发生、神经生物学、病毒发病机制、动脉粥样硬化、癌症和衰老都具有重要的生物学和临床意义。
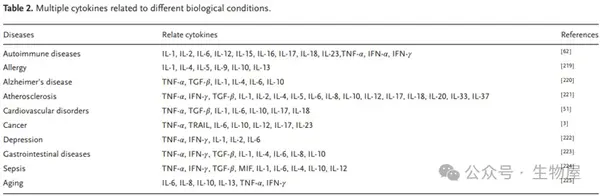
表 2说明了与各种细胞因子相互作用相关的不同典型疾病,这支持了细胞因子作为多种自身免疫和炎症疾病的生物标志物的模型。
[影响生物体液中细胞因子定量的因素]
血样处理对细胞因子稳定性的影响
o 已知大多数细胞因子在体内的半衰期很短(表 1),并且在样品收集和制备过程中会快速降解,如果不采用适当的血液处理程序,这会导致假阴性信号。
o 血清和血浆源自全血,并在采血后进行不同的处理方式。血清是凝固血液的可溶部分,是血液凝固后获得。在凝块形成过程中,血细胞可能会被激活,细胞因子可能会从血小板释放到血清中(例如 IL-1、IL-6 和 IL-8)。
o 血浆是抗凝血液的可溶部分,在从全血中分离血浆之前,白细胞可以在体外分泌细胞因子并改变血浆中细胞因子的水平。为了获得血浆,在去除血细胞之前可以使用各种抗凝剂,例如乙二胺四乙酸(EDTA)和肝素锂/钠,从而抑制凝血和补体系统的激活。
o 研究表明,使用各种抗凝剂、内毒素管污染和血液处理(离心)延迟会对血浆或血清中的细胞因子浓度产生重大影响,并可能导致细胞因子测量值错误地增加或减少。例如,肝素(全血处理中的抗凝剂)可以诱导单核细胞释放细胞因子;肝素锂和柠檬酸钠被证明会影响 IL-6 和 TNF-α的水平,这可能归因于抗凝剂诱导的血细胞释放细胞因子,特别是在肝素血浆中,但在 EDTA 血浆中则不然。
o Friebe和Volk报道了血液样本中TNF-α 、IL-6和IL-8的稳定性,发现肝素血浆和血清中TNF-α和IL-8的水平增加,但它们在EDTA血浆中的浓度稳定。相比之下,所有血型的 IL-6 水平在 8 小时内保持稳定。与血浆中的细胞因子水平相比,血清中较高的细胞因子水平表明凝血过程促进了细胞因子的释放,这一结果与之前的研究结果一致。使用 EDTA 采集血浆似乎能带来最一致的结果,并且更接近于血清中获得的数据。总之,EDTA 血浆似乎最适合细胞因子测量,主要是出于稳定性原因。
o 此外,尽管血液采集和到达实验室进行测试之间总是存在时间间隔,但通常建议快速制备样品。
样品储存对细胞因子稳定性的影响
o 为了获得可靠的结果,许多研究检查了储存对血液中细胞因子水平的影响。
o Cohen等评估了样品储存对血浆中 IL-6、IL-10、IFN-γ和 IL-2 测量的影响,全血在室温下储存会导致细胞因子水平降低,但全血在 4°C 下储存会导致细胞因子稳定性。
o Vincent等最近评估了血清冷冻前储存时间对细胞因子稳定性的影响,并将结果与从系统性红斑狼疮 (SLE) 患者获得的血浆样本进行了比较。在这项研究中,患者的血清和血浆样本在冷冻前预先在 4°C 下储存 0-30 天的预定时间,几乎所有分析的细胞因子(12 种中的 11 种)在冷冻前在 4°C 下保存长达 30 天时都是稳定的,只有单一分析物趋化因子(C-C 基序)配体 19 (CCL19) 从 4 °C 储存的第4天起显示出显著的信号衰减。与血浆相比,大多数分析物在未分离的血清中的细胞因子水平更稳定,但 IL-37 除外,它在血浆中似乎稍微更稳定,本研究建议未分离的血清样品在 4 °C 下最多可保存 3 天。
o Valaperti 等研究表明许多细胞因子在室温下采集样品后可以在短时间内保持稳定,建议快速处理和冷冻新鲜采集的全血样本,以避免假阳性结果。
o Panicker 等研究了在采集宫颈粘液时速冻和冷藏的效果,TNF-α、IFN-γ和 IL-1β在冷藏样品之间存在显著差异,显示每种细胞因子的水平较高,这一发现表明在收集后立即冷藏粘液样本可以更好地保存宫颈粘液中的细胞因子。
冻融对细胞因子稳定性的影响
o Simpson等总结了样品在不同温度下储存或暴露于重复冻融循环时 33 种细胞因子的稳定性,由于通常使用预先解冻的样品,因此冻融稳定性评估是细胞因子测量的一个重要考虑因素。
o 经过多次冻融循环后,细胞因子的水平可以稳定、增加或减少,并且每种细胞因子的水平都不同。一般来说,大多数细胞因子在最多3次冻融循环中保持稳定。
o Jae 等评估了反复冷冻和解冻对不同细胞因子的血浆和血清浓度的影响,在反复冻融循环期间,血浆和血清中的 IFN-γ和 IL-8水平保持稳定。然而,某些细胞因子的浓度随着每个连续的冻融循环而变化,在三个循环后变得显著。
o Henno 等研究了冷冻和解冻对 EDTA 和柠檬酸盐血浆中细胞因子稳定性的影响,并报道血浆冷冻和解冻最多3次后细胞因子水平没有显著变化。然而,冷冻和解冻6次后,EDTA血浆中的 IL-1β水平出现轻微但具有生物学意义的下降,而 CCL5 水平则有所上升,这表明样品处理最多进行3次冻融循环,以便进行准确的细胞因子分析。
o 一般来说,为了保持细胞因子水平稳定以进行准确测量,样品应进行最小程度的冻融。
·可溶性细胞因子受体对细胞因子检测的拮抗和激动作用
o 可溶性细胞因子受体或细胞因子结合蛋白(例如 IL-18 binding protein,IL-18BP)由膜结合受体的蛋白水解裂解或由细胞释放,并出现在生物体液或组织培养上清液中的选择性剪接 mRNA 的翻译产生,这些受体作为竞争性抑制剂,在体外对其各自的细胞因子具有拮抗作用。
o 有许多例子说明大多数可溶性细胞因子受体可以干扰细胞表面受体并与细胞表面受体竞争游离细胞因子的结合,因此细胞因子受体阻止细胞因子结合其特定的膜受体并产生信号,从而抑制细胞因子活性。
o 可溶性细胞因子受体的拮抗作用可能在免疫反应的下调和某些细胞因子“过度活跃”的抑制中发挥重要作用。例如,Levine 报道可溶性 IL-1 受体可以通过优先结合 IL-1β 来减弱过度的 IL-1 生物活性。
o 尽管大多数可溶性细胞因子受体具有作为细胞因子的竞争性抑制剂的能力,但一些受体可能在体内增强其自身细胞因子的活性或具有与作为载体蛋白的附加作用一致的特性。
o 这种类型的可溶性受体通过与细胞因子的信号转导亚基相互作用来增强而不是抑制细胞因子的活性,从而产生信号(即可溶性 IL-6 受体 (sIL-6R) 和糖蛋白 130 (gp130))。与可溶性 IL-1 受体对 IL-1 信号的拮抗作用相反,Levine 报道了 sIL-6R 对 IL-6 信号放大的激动作用。因此,细胞因子与其可溶性受体的结合可以提高细胞因子的分子稳定性,从而导致活性降低。这一假设与生物活性 TNF三聚体与可溶性 TNF 受体的结合减缓其分解为无活性单体的观点一致,从而导致长期孵育后生物活性增加。
o 可溶性细胞因子受体的这些拮抗和激动作用可能会影响细胞因子的检测。一项研究表明,在某些情况下,例如炎症性疾病,生物体液中可溶性细胞因子受体的存在可能会干扰免疫测定,例如基于微珠的多重免疫测定和 ELISA。
o 几种细胞因子,特别是IL-1β、TNF-α和IL-6,可能与可溶性受体结合,形成免疫测定无法识别的结合形式。例如,在癌症患者中,竞争性免疫测定通常可检测到 TNF-α,但 ELISA 测定在癌症患者血浆中未检测到TNF-α,这与生物测定数据一致。Engelberts等研究了这些效应,并表明与 p55 TNF 受体结合的TNF-α不能被夹心 ELISA 测定很好地识别。
o 此外,就 IL-6 而言,血浆中含有几种结合形式的IL-6,分子量范围为50-150 至 400-500 kDa,与某些抗血清反应较差,并且由IL-6与可溶形式的IL-6 受体形成复合物,这引发了关于血浆中 IL-6 实际浓度的争议。大多数免疫测定发现正常血浆中IL-6的浓度无法检测到或范围在10-75 ng/L之间,在脓毒症中水平上升至1-2 µg/L,或者在脑膜炎球菌疾病中甚至是200 µg/L。
o 然而,May等报道大多数检测仅识别低分子量的 IL-6,使用识别高分子质量形式的单克隆抗体检测,在正常血浆中的 IL-6 浓度为 1-10 µg/L,并且在骨髓移植后患者的血清样本中,浓度为 5-10 mg/L。
o 因此,有必要确切地知道测定法正在测量细胞因子或细胞因子复合物的哪些成分,并且最好应考虑可溶性受体的水平。
[细胞因子检测技术]
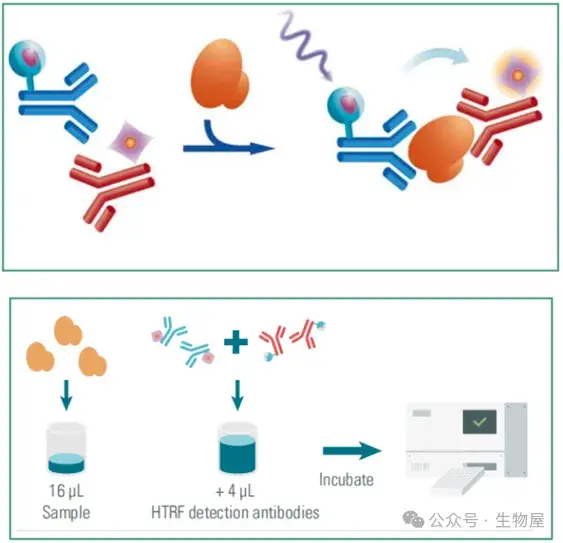
·Revvity HTRF技术
o 均相时间分辨荧光(Homogeneous Time-Resolved Fluorescence, HTRF)技术采用夹心分析法检测,使用两种不同的特异性抗体,一种用Eu(供体)标记,另一种用d2(受体)标记。当标记的抗体与同一抗原结合时,供体用光源(激光或闪光灯)激发,触发向受体的荧光共振能量转移(FRET),进而在特定波长(665nm)发出荧光。这两种抗体与样本中存在的T细胞因子结合,从而产生FRET。信号强度与形成的抗原-抗体复合物的数量成正比,因此也与检测的细胞因子浓度成正比。
o 实验仅需在空板中加入16μl检测样本,然后加入4μl检测抗体孵育2小时后即可使用酶标仪进行读数。
o HTRF技术检测细胞因子试剂盒体系中使用相同的buffer和低样本的需求,所以,实验允许从同一上清液中平行地定量多种细胞因子,可同时检测3个以上的细胞因子。仅需将样本加入孔板内,依次加入不同检测试剂即可实现不同细胞因子的检测。
Revvity AlphaLISA技术
o AlphaLISA技术同样采用夹心法检测细胞因子,一个抗体被生物素化并与链霉亲和素包被的供体微珠结合,受体微珠则直接与另一个抗体结合。细胞因子存在的情况下,抗体与细胞因子结合使供体和受体微珠靠近,供体微珠的激发使得单线态氧扩散至受体微珠,从而发射615nm波长的光信号,AlphaLISA的检测信号与样本中存在的细胞因子的数量成正比。
o AlphaLISA技术是均相体系、操作方便、无洗涤步骤、2h完成检测;节省样本,样本需求低至5μl;体系稳定,批次间重复性高;灵敏度高,实验窗口大,线性范围宽;高通量,兼容96/384/1536孔板。
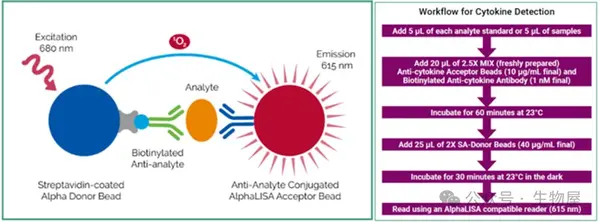
·放射免疫分析法 (RIA)
o 放射免疫分析法对生物样品中的细胞因子定量具有较高的敏感性和准确性,就像其他免疫测定法,RIA法需要先标记的细胞因子特异性抗体和/或标记的细胞因子或其受体与放射性同位素(主要是 I125) ,然后再进行检测。
o RIA的一个特殊优势是它对细胞因子的生物活性区域具有特异性,而不是对免疫活性区域的特异性,免疫活性区域可能很少或不参与细胞因子活性的表达。
o 但是,涉及使用放射性同位素的测定法大部分已被非放射性测定法所取代,因为考虑到辐射照射、劳动密集耗时的程序和昂贵的设备要求。
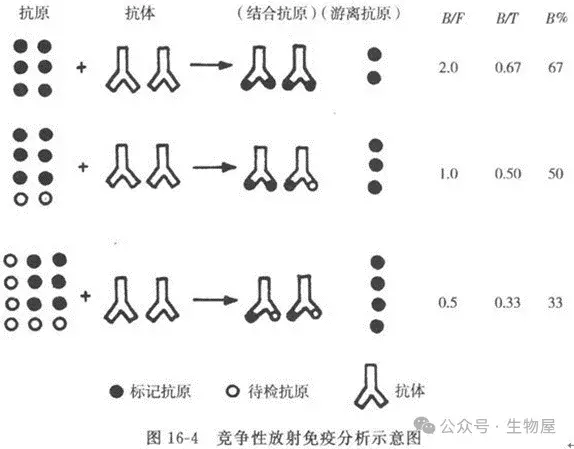
·DNA微阵列
o DNA芯片或微阵列的广泛应用允许在mRNA水平上同时分析来自不同组织或细胞的数千个基因的表达,该技术可用于确定表达细胞因子的基因在响应外部信号、细胞应激和各种病理条件时的上调。
o 微阵列是一种基于微杂交的检测方法,通过构建DNA微阵列,利用抗体-DNA与目标蛋白质的夹心免疫反应,产生邻位效应促使DNA杂交,进一步打开DNA微阵列上的捕获发卡DNA并引发杂交链反应,通过生物素-亲和素反应,使得大量辣根过氧化物酶(HRP)在DNA微阵列上结合,产生化学发光信号放大,实现多种蛋白质的同时、高灵敏图像检测。
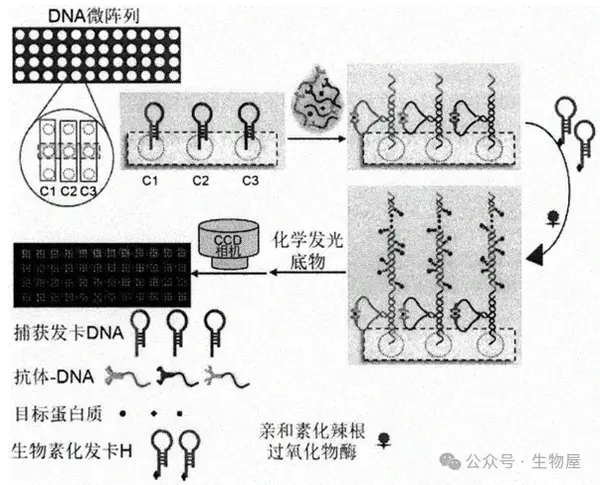
·抗体芯片
o 抗体芯片是一种可靠而稳健的方法,用于从复杂蛋白质组中提取多重数据,具有高灵敏度、高特异性和高通量。第一个抗体芯片是由Chang于1983年开发的,在1cm2面积的玻璃盖玻片上发现了10×10和20×20网格中的抗体。
o 当前抗体芯片多用三明治夹心或直接标记,使用化学发光或者荧光进行检测。三明治夹心抗体芯片使用抗体对,必须验证和检查与阵列中所有其他抗原/抗体的交叉反应性。
o 出于这个原因,芯片一般涵盖10-80个分析指标,通过组合多个阵列,可以检测和定量人体样品中多达1000种分泌的人类蛋白质,如细胞因子、趋化因子、脂肪因子、生长因子、蛋白酶、可溶性受体和其他蛋白质。此外,小鼠、大鼠、牛、羊等不同种属的芯片,也正在开发中。
·单分子技术
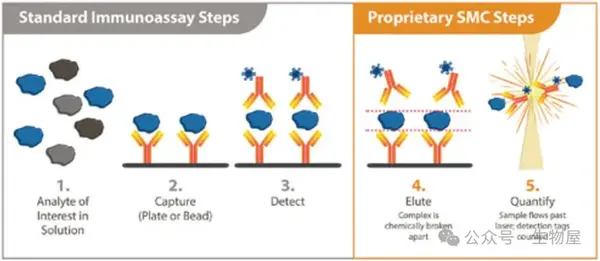
o单分子计数(Single Molecule Counting, SMC)技术最初由Singulex公司开发,将基于磁珠的免疫测定与单分子计数检测相结合。
o 经典的 96 孔板中,基于磁珠的免疫测定法用于形成夹心复合物(捕获抗体-抗原-荧光标记的检测抗体包被的磁珠)。然后,破坏夹心复合物,并使用专有的数字SMC技术分析洗脱的荧光标记检测抗体,使用激光共聚焦显微镜数字计数器对单分子荧光信号(“闪光”)进行计数。
o SMC 检测试剂盒可检测人体样品中的细胞因子,灵敏度为sub-pg/mL。
·免疫PCR技术
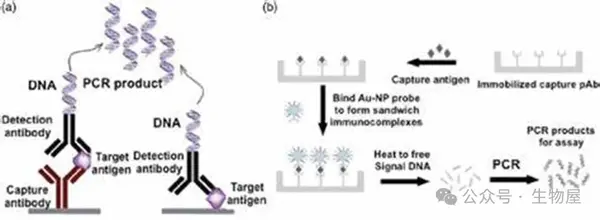
o 免疫PCR最初描述于1992年,结合免疫测定的高特异性和聚合酶链反应(PCR)的高灵敏度。与传统ELISA中底物和产物之间的线性关系相比,免疫PCR可实现信号指数级放大,灵敏度比普通ELISA高1000倍。
o 夹心形式的免疫PCR,与夹心ELISA相同,在捕获抗体包被的96孔板中进行。与 ELISA 测定中用于检测的酶抗体偶联物不同,免疫 PCR利用与 DNA 共价偶联并通过定量 PCR 检测的检测抗体。
o 虽然免疫PCR的优点是显而易见的(例如,超灵敏、良好的重现性和普遍性),但其主要局限性是背景高且需要大量的洗涤步骤。
·者邻近连接技术
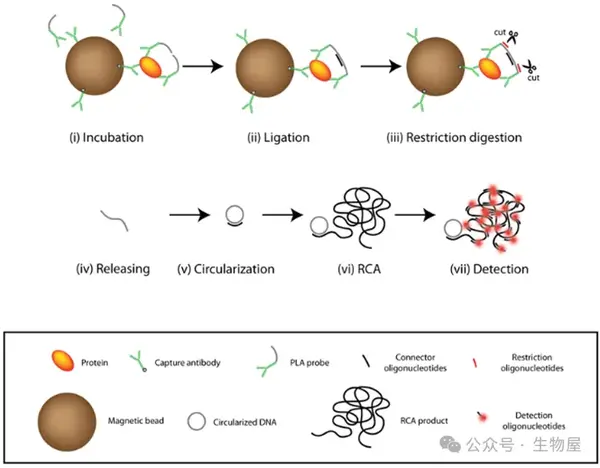
o 者邻近连接测定(Proximity ligation assay, PLA)最初由Fredriksson等开发,使用对血小板衍生生长因子(PDGF)具有亲和力的DNA适配体来量化PGDF。
o 同源二聚体PDGF-BB可以容纳两个适配体分子,每个分子都具有引物结合的延伸和额外的延伸,在杂交到共同的连接器寡核苷酸时进行连接。
o PCR产物的实时检测可检测到低至10-20 pmol浓度的细胞因子/蛋白。
·免疫磁减量检测
o 2006年首次描述了磁减量生物分析技术,目前的免疫磁减量(Immunomagnetic reduction, IMR)测定,将捕获抗体固定在磁性纳米颗粒,这种纳米颗粒均匀分散在溶液中,并通过施加外部多个磁场(即易受磁场影响)而振荡。加入分析样品后,由于抗体捕获分析物分子,纳米颗粒变得更重,导致纳米粒子对磁场的响应降低,降低程度对应于样品中存在的目标分子的量,能够检测pg/mL浓度的细胞因子/蛋白。
o IMR测定的主要优点是它是一种简单的技术,不需要洗涤步骤即可去除未结合的试剂,具有高度的灵敏度和定量性。例如,淀粉样蛋白-β1-42和α-突触核蛋白的浓度范围分别为1-50000 pg/mL和0.3 fg/mL-300 pg/mL。
o 与夹心免疫测定不同,IMR测定仅使用一种抗体(“捕获”抗体),测定特异性通过纳米颗粒的振荡运动来确保,其中微弱的非特异性抗原-抗体相互作用由于施加磁场在纳米颗粒上引起的离心力而被破坏。
o IMR测定目前旨在识别疾病的早期阶段,例如神经退行性疾病、癌症和病毒感染。
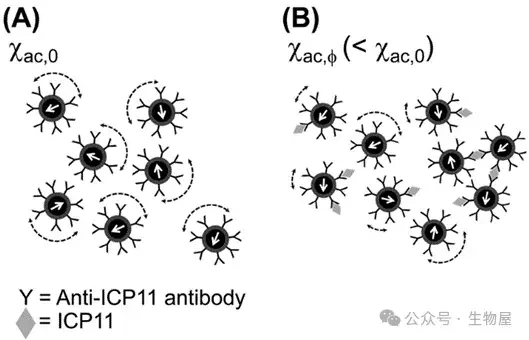
图1. 免疫磁减量(IMR)检测原理
- 每个磁性纳米粒,具有针对目标蛋白的抗体的生物功能,在与ICP11结合之前,在施加的交流电(AC)磁场下振荡。χac,0:磁性纳米粒的原始多频交流磁化率。(B)当这些磁性纳米粒与靶蛋白结合时,它们变得更大,有些甚至形成簇状,这降低了试剂的交流磁化率。χac,φ:磁性纳米粒与靶蛋白结合后的磁化率。
·微流体技术
o Usuba 等制造了一个具有微流体结构的光子芯片(Photonic lab-on-a-chip, PhLoC),用于快速检测 IL-2。
o PhLoC包括光学元件、测量室、空气旁路和其他用于引入和冲洗溶液的流道,流道仅能够将溶液引入测量室并改善抗体在测量室表面上的固定,淋巴细胞分泌的 IL-2 可在 15 min内测量,浓度范围为 50-1000 pg/mL。
o 在芯片实验室设备中,微流控技术为实现更快速、更高效的体外检测提供了有效的解决方案,因为1)微流控通道具有较大的表面积与体积比,加速了抗原抗体反应;2)微流控技术平台最大限度地减少了昂贵试剂和珍贵样品的消耗;3)可以通过将多个传感器集成到通道中来实现多重分析。
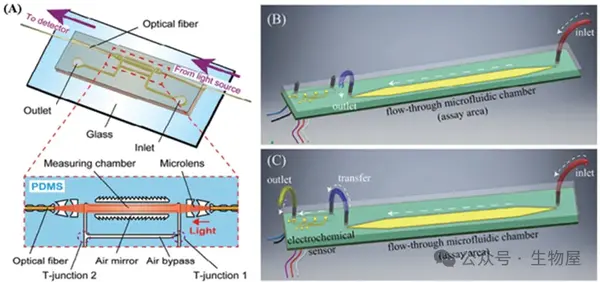
图2. 不同类型的微流控法检测细胞因子原理图
- 具有集成光学和微流体组件的 PhLoC 示意图;B) 测定初始阶段单位细胞流体排列的 3D 图形表示;C) 测定第二阶段期间单元电池流体布置的 3D 图形表示,详细说明了 Proxim 手持式仪器的测定区域和电化学传感器测试盒之间的流体端口和连接。
·质谱细胞术
上一篇:生物制品宿主核酸残留控制利器—逐典Pannarase全能核酸酶及ELISA检测试剂盒! 下一篇:Nature子刊:里程碑!新技术ENTER,突破药物递送极限




