近年来,生物制品在市场中所占比重越来越大,与之俱来的生物安全性问题也随之而来。我国参照WHO、FDA和欧盟的标准,在药典中明确规定酵母、大肠杆菌表达的生物制品中的DNA残留量不超过10ng/剂,CHO和vero细胞表达的EPO、狂犬疫苗、乙肝疫苗等不超过100或10pg/剂。
生物制品的核酸残留去除主要集中在病毒疫苗生产、重组蛋白药物纯化、细胞治疗和疫苗研究中缓解PBMC细胞结团以及慢病毒的大规模纯化等。翌圣生物UCF.METM核酸酶可降解无论是单链、双链、线性、圆形还是超螺旋形式的DNA及RNA,无碱基偏好性。UCF.METM核酸酶具有极高的核酸酶活性以及超强的耐受性,可适用于多种操作环境,短时间内就使样品中所有的游离核酸降解成长度为3-5个碱基的5’末端的寡核苷酸。
逐典生物提供高品质全能核酸酶,为生物制品解决宿主核酸残留困扰。
一,病毒疫苗生产
疫苗的使用者是健康人,并且许多疫苗已用于婴幼儿。因此,药品监管机构应更加注意生物产品的安全性,尤其是残留DNA和RNA的质量控制。现阶段病毒疫苗纯化主要是采用凝胶渗透色谱法。但是,疫苗中残留的Vero细胞DNA经常超过规定的最低限度。Li Si-Ming等在2014年发表的文献中指出,全能核酸酶能够有效去除疫苗中残留的宿主细胞DNA。经过核酸酶的病毒疫苗,再用离子交换层析的方法进行纯化,可以将疫苗中的核酸残留量降到限值以下,并且显著提高了生产回收率。Komatsu Y等的研究表明,全能核酸酶处理对病毒的感染效率无显著影响。

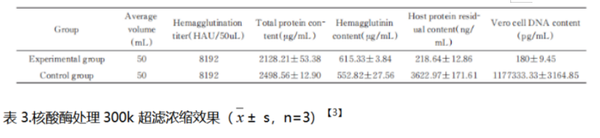
图1. 点片法检测经核酸酶处理的疫苗半成品中的核酸残留
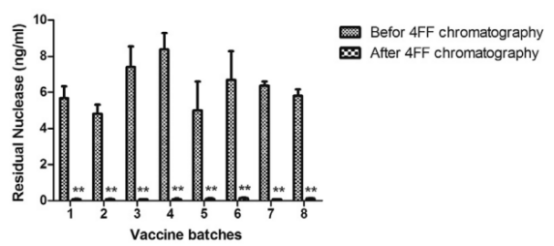
图2. 经过核酸酶处理的样品,残留量降至100pg/mL以下
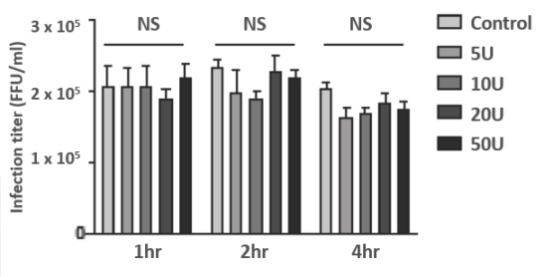
图3. 核酸酶的处理对病毒感染效率无显著影响
二,重组蛋白药物残留核酸去除
在传统的放化疗治疗的局限下,重组蛋白药物逐渐成为肿瘤治疗领域的研究热点。为了临床治疗的需要,重组蛋白产品的使用剂量已从微克增加到毫克或甚至是克,并且大多数生物制品需要长期重复给药。目前的重组蛋白药物主要来源于CHO细胞,细胞经过常规的14天反应器fed-batch培养,密度最高可以达到3×107个/mL。因此,重组蛋白药物中的核酸残留去除极为重要。
三,防止细胞结团
从全血中分离出的外周血单核细胞(PBMC),在细胞治疗和疫苗研究中有重要应用,但是,冷冻PBMC(特别是从储存的血液中提取的PBMC)解冻时容易成团,阻碍进一步分析。2015年,Lin D等人制定的protocol中明确说明,在PBMC解冻缓冲液中加入全能核酸酶,可以有效防止细胞成团,从而实现PBMC的冷冻保存,该方法被广泛用于疫苗评估和CAR-T细胞疗法研究中PBMC细胞的复苏。
四,慢病毒的大规模纯化
慢病毒介导的基因治疗和细胞治疗将会很快成为不仅是罕见遗传病,也会是血液肿瘤、HIV等感染性疾病的常规治疗方法。可扩大的慢病毒生产工艺的改进变得越来越迫切。除了载体的滴度及产量,对于慢病毒批次更关心的指标主要是各种污染物的去除。如下图,在工业化生产领域,慢病毒大规模纯化的常用步骤包括:用膜过滤澄清,随后用切向流过滤/超滤或者体积排阻色谱来浓缩。所有机构的病毒纯化流程中都采用了全能核酸酶来降低细胞残留的以及质粒来源的DNA污染。
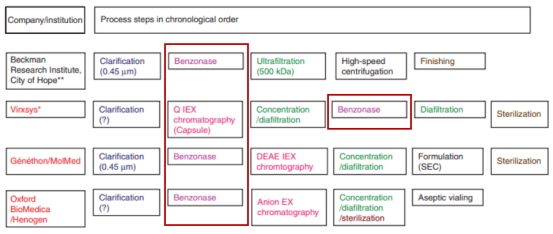
图4. 不同公司/研究所采用的慢病毒大规模纯化步骤中均含有全能核酸酶处理步骤
表1. 3种不同级别UCF.METM核酸酶质检结果
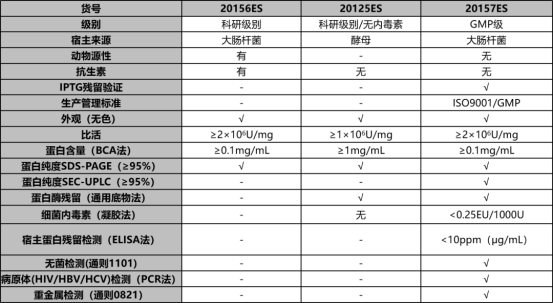
注:检测并合格(√);无检测该指标(-);
五,逐典Pannarase全能核酸酶优势:
1.无动物源性、无氨苄青霉素
2.杰出单位比酶活、更高效的核酸降解能力
3.先进的生产工艺,非传统His标签纯化、排除引入金属离子风险
4.严格的质控标准,内毒水平低,确保单位酶活的准确性以及批次间稳定性
1,全能核酸酶应用条件:
全能核酸酶的酶活会受到多种因素的影响(例如温度、pH、离子强度等),故用量范围也会从0.1 U/mL-250 U/mL不等。因此,不同的操作环境下酶的最佳浓度不同,需要通过实验设置梯度进行最佳条件的摸索。
2,应用实例:
1.样品:狂犬病毒浓缩液
处理条件:核酸酶浓度50~90U/ml ,
37 ℃处理 2 h,转入18 ~ 26 ℃处理 6h
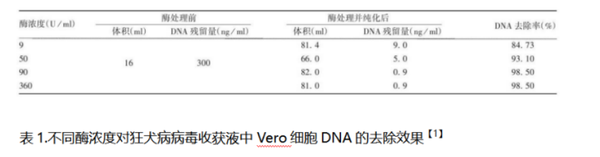
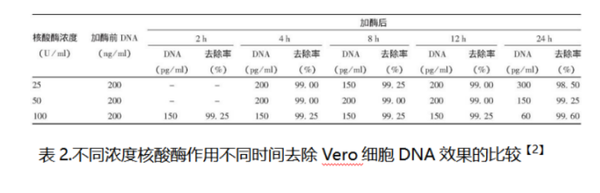
2.样品:狂犬病病毒浓缩液
处理条件:25、50和100 U/ml,37℃
3.样品:流感病毒浓缩液
处理条件:10 U/mL,37℃