尽管有些肿瘤或疾病确实是由于基因组本身遗传信息改变所致,但是表观调控有时能更好地阐述肿瘤或疾病发生的机制。在课题进展中,尤其是在确定表型之后,我们往往从表观调控,或转录调控,或蛋白修饰的方向去研究表型发生的机制。差异基因与表型间的关系往往是比较容易确定的,机制的挖掘则相对复杂!荧光素酶报告系统(Luciferase reporter)是检测转录因子与目的基因启动子区DNA相互作用的一种检测方法。作为机制研究利器,如果我们想要研究某个转录因子是否能与某一靶启动子片段有作用。首先将靶基因启动子或其他待研究基因调控元件插入到荧光素酶报告基因前方,构建成报告基因质粒。然后,将可以表达待检测转录因子质粒与报告基因质粒共转染细胞;如果此转录因子能够激活靶启动子,则荧光素酶基因就会表达,荧光素酶的表达量与转录因子的作用强度成正比;再加入特定荧光素酶底物,荧光素酶与底物反应,产生荧光。通过检测荧光的强度可以测定荧光素酶的活性,从而判断转录因子是否能与此靶启动子片段有作用。下面小编就给大家介绍一篇荧光素酶在肿瘤机制研究中的应用案例实验步骤。
第一步:稳转荧光素酶(Luc)基因的肿瘤细胞系构建。
这篇文章采用的是慢病毒递送的方式,也是目前构建稳转细胞系的主流方法。用含有Luciferase基因的慢病毒质粒+MD2G+psPAX2,三质粒共转染293T细胞,48-72小时收细胞上清,然后用去除细胞碎片的慢病毒感染肿瘤细胞。感染48-72小时后,用WB或流式或荧光显微镜验证转导效率。这里同时插入了Luc和EGFP,中间用IRES隔开,Luc和GFP独立表达,非常巧妙,当然也是常用的实验手段。
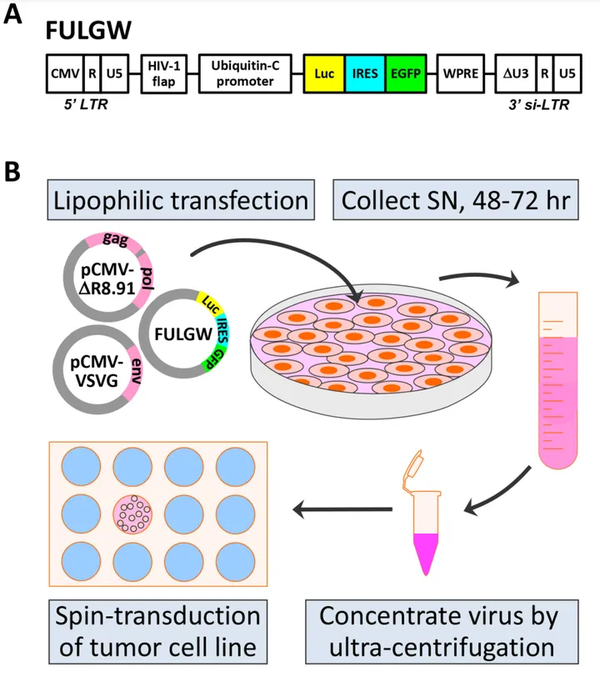
第二步:稳转细胞系的验证。
作者同时插入了Luc和GFP,因此下面同时用了流式检测GFP阳性率和用荧光素酶检测试剂盒检测了Luc的表达水平。因为有时候慢病毒整合的位点和拷贝数不一样,会破坏宿主基因的表达,可能出现一些好的克隆和差的克隆。作者挑取了3个克隆,从流式和Luc检测结果来看,#12克隆最好。
在此,建议大家在做稳转细胞系的时候,至少要挑选和尝试3个以上的克隆~

流式细胞术评价肿瘤细胞系的转导
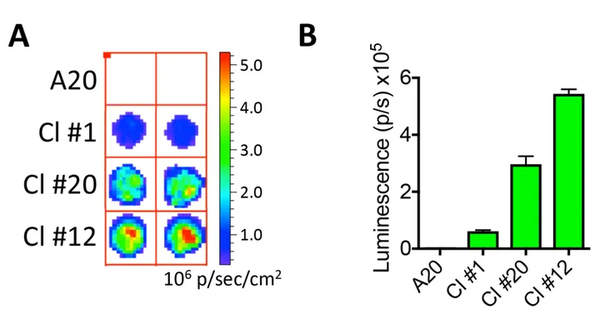
荧光素酶表达验证
第三步:体内肿瘤模型的建立。
此外,作者还进行了皮下接种(subcutaneous,s.c.)和静脉注射(intravenous,i.v.)稳转的肿瘤细胞系,并分别在接种后第7天和第10天进行体内成像。与体外结果一致,#12克隆诱导肿瘤的效果最好。到这里已经成功建立了小鼠肿瘤模型,后面就可以用作肿瘤治疗或敲除的模型了。

监测小鼠白血病模型中的肿瘤负荷
荧光素酶报告系统并不是一个新技术,也不是多么高大上,但是绝对是机制研究的利器。
逐典萤光素酶报告基因
针对报告基因检测不同的侧重需求,逐典推出了3种检测系统。

逐典萤光素酶报告基因特点:
1. 检测灵敏度高,信号稳定性好
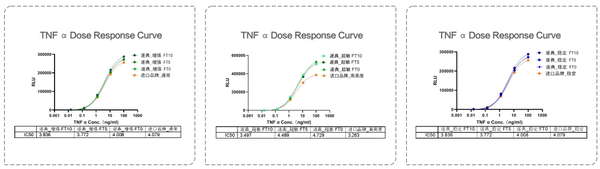
HEK293-NFK B-LUC细胞加入梯度稀释的TNF 在37C、5%CO条件下刺激6小时后,分别用增强型、超敏型、稳定型检测试剂进行信号检测。
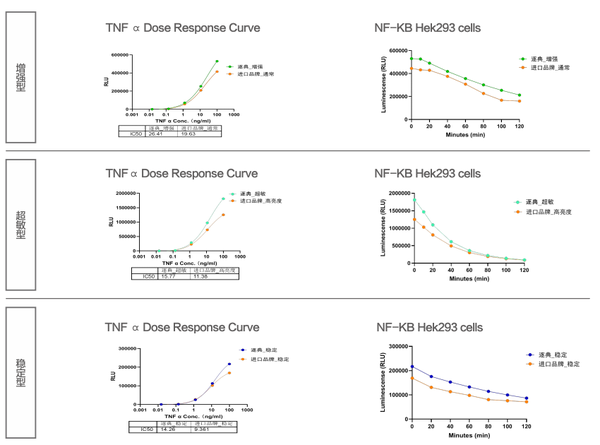
2. 操作方便
仅需将底物和萤光素酶检测缓冲液混合后直接加入到细胞即可。

3. 稳定性好
同时在10次反复冻融实验中,逐典全系列报告基因检测试剂盒显示出较强的稳定性。