为更好满足AAV病毒纯化过程中高盐环境对全能核酸酶的活性要求, 逐典生物自主开发出耐高盐版本全能核酸酶,在高盐条件下,仍具有高酶活,是AAV病毒生产及其它生物工艺流程中去除核酸污染的理想选择。
基因治疗是一种利用基因治疗载体将外源的治疗性基因转导至细胞,通过外源基因的转录和翻译,改变细胞原有基因表达以治疗疾病的方法。腺相关病毒(AAV)载体具有不整合宿主基因组、靶向组织特异性等核心优势成为最通用和最成功的基因治疗递送载体之一。随着AAV基因治疗的研究从实验室开发转向临床规模化生产,AAV病毒载体的上游生产和下游纯化过程仍然面临重要挑战。
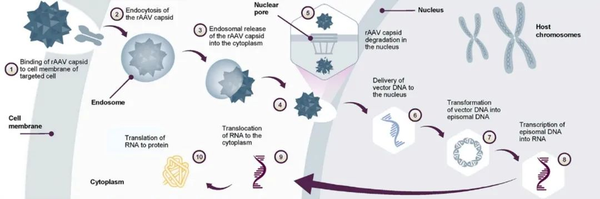
AAV gene transfer therapy mechanism of action. Mol Ther Methods Clin Dev. 2022;25:74-83.
一,AAV病毒的工业生产
AAV病毒载体的生产流程跟抗体、疫苗类药物的生产类似,主要包含上游培养、下游纯化以及制剂部分。其中,病毒生产流程的后半部分需要从工艺和产品相关的杂质中纯化病毒颗粒,这些下游处理步骤可能占病毒生产总成本的很大一部分,因此高效地产生高纯度病毒非常重要。一般下游操作主要包括:(1)用去污剂、机械作用、高渗或冻融操作裂解细胞释放病毒;(2)核酸去除,裂解物经全能核酸酶消化以减少核酸污染物;(3)在色谱纯化前通过离心或微滤去除细胞碎片和碎片;(4)亲和层析,去除宿主细胞蛋白(HCPs)和任何血清蛋白杂质;(5)用氯化铯梯度超离心法从空壳病毒、非感染性病毒中分离包含全基因的完整病毒颗粒。
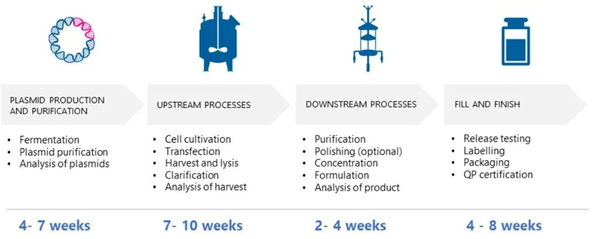
Timeline for GMP manufacture of AAVs – Example
二,常规全能核酸酶在AAV生产中的作用和限制
根据WHO和各国药物注册监管机构要求,生物制剂中残留的宿主DNA的剂量不得超过100 pg/剂量,部分特殊情况下不得高于10 ng/剂量,基于此,常使用全能核酸酶应用于生产工艺流程中来去除核酸污染。在AAV病毒生产中,经宿主细胞大量扩增,在细胞裂解后,往往需要加入全能核酸酶来去除核酸污染,同时可以降低粘样品稠度,便于后续上柱纯化。值得注意的是,在AAV病毒纯化过程中,为提高病毒收率,常使用含有较高盐浓度的buffer(400-500mM),而常规版本全能核酸酶的酶活会随着盐浓度升高而急剧下降,实际使用中,常需要通过增加酶的用量或延长孵育时间来提高纯化效果,但这无疑增加了AAV纯化成本和工艺复杂度。
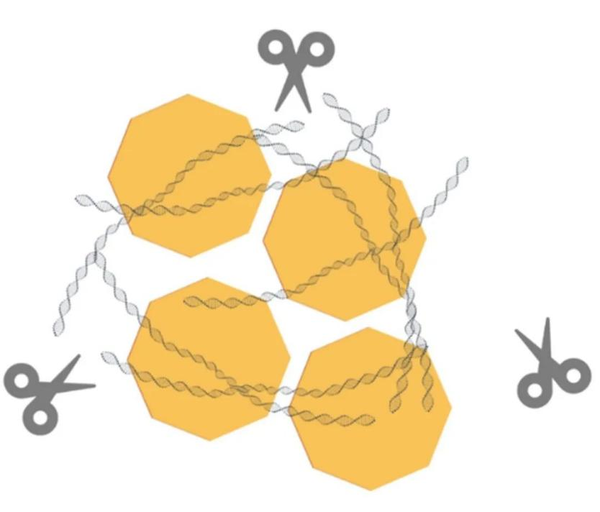
宿主核酸与AAV病毒缠绕在一起,影响核酸酶的酶切效果
实际上,盐是各种纯化方案的重要组成部分,盐浓度的提高可有效地减少AAV病毒颗粒的聚集,提高AAV病毒颗粒产率。
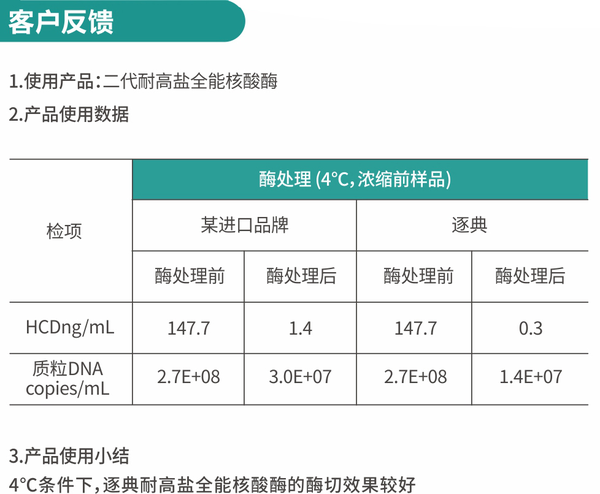
三,逐典耐高盐核酸酶应用案例:
四,逐典耐高盐全能核酸酶优势
1.更高盐耐受度
当盐离子浓度在600~700mM时,初代全能核酸酶几近失活,而SAN仍能保持较高活性。
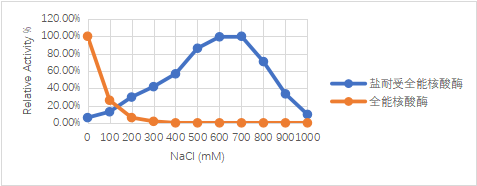
图1.不同盐浓度下耐高盐全能核酸酶(SAN)与初代全能核酸酶活性对比
2.高效核酸降解力
同对照组相比,添加SAN后能够有效去除核酸残留。
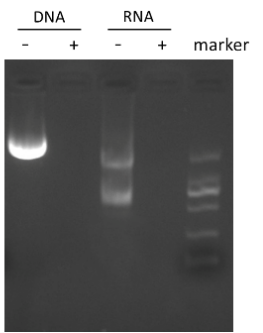
图2 加入SAN 前后的消化效果图




