随着生物医药行业的蓬勃发展,利用生物技术制备的产品安全性更加备受关注,其中宿主核酸的控制与去除是至关重要的。一般的生物制品使用全能核酸酶即可去除宿主核酸,但一些广泛应用于基因及细胞治疗领域的生物制品制备和纯化工艺需要在较高盐浓度进行,需要高盐条件下具有高活性的核酸酶。上海逐典成功开发的耐盐核酸酶产品,在600-700mM时仍保持较活性,可以更高效、低成本的去除宿主核酸。
一,宿主DNA残留控制的法规要求
生物制品在生产过程中通常会使用工程细胞(菌)作为宿主。宿主的核酸残留,特别是DNA残留会引入免疫原性、致瘤性、感染性、干扰代谢等潜在的安全风险,因此各国药品监督管理机构对生物制品的宿主核酸残留量都有着严格的限度控制。
各国法规对不同生物制品的宿主核酸残留控制限度要求不同,残留量一般控制在0.1-10ng/剂,如有残留片段大小的限制要求,一般控制在200 bp以下。如《中国药典》(2020版)规定,疫苗类宿主DNA残留一般控制应在0.05-10ng/剂。《体内基因治疗产品药学研究与评价技术指导原则(试行)》中建议:“如有可能,建议尽量将残留DNA控制在10ng/剂以内,DNA残留片段的大小控制在200bp以下。”美国FDA颁布的《Chemistry, Manufacturing, and Control (CMC) Information for Human Gene Therapy Investigational New Drug Applications (INDs)》中要求宿主DNA残留需控制在低于10ng/剂,并且DNA大小需小于200 bp。
二,《中国药典》(2020版)部分生物制品残留DNA限度要求
| 生物制品名称 | 限度要求 |
| 人胰岛素 | 每1.5mg人胰岛素中不得超过10ng |
| 注射用人生长激素 | 每1mg人生长激素中不高于1.5ng |
| 尼妥珠单抗注射液 | 每1支/瓶不高于0.1ng |
| 重组乙型肝炎疫苗(酿酒酵母) | 不高于10ng/剂 |
| 冻干人用狂犬疫苗(Vero细胞) | 不高于3ng/剂 |
| 冻干型乙型脑炎灭活疫苗(Vero细胞) | 不高于 0.1ng/剂 |
| Sabin株脊髓灰质炎灭活疫苗(Vero细胞) | 不高于 0.05ng/剂 |
三,宿主DNA残留控制面临的挑战
来源于粘滞沙雷氏菌的非特异性核酸酶,如SuperNuclease等,已广泛应用于上市药品生产过程中的宿主核酸控制。虽然在生理盐条件下的体外水解实验中,这类酶可以迅速水解鱼精DNA或小牛胸腺DNA,生成小于8nt的寡核苷酸产物,但是在复杂的工艺条件下使用仍面临着众多挑战。例如:
*宿主DNA通常以染色质的形式存在,且被包裹于含有宿主细胞碎片的复杂基质中,有时需要在高于生理盐浓度的盐离子中才能使DNA和蛋白质有效分离。
*AAV等一些病毒载体易发生聚集,在低盐条件下稳定性差,需要在中、高盐的缓冲液中才能保证其活性。因此需要核酸酶在中、高盐的条件下具有高活性,保证病毒载体的回收率。
*在纯化工艺环节中,如利用高盐洗脱的层析样品中的宿主细胞核酸含量偏高,需要采取相应措施降低宿主核酸含量。
除此之外,传统核酸酶的活性会随着盐浓度升高而急剧下降,在中、高盐条件使用这类核酸酶会造成生产成本显著增加。
四,逐典耐高盐全能核酸酶优势
1.更高盐耐受度
当盐离子浓度在600~700mM时,初代全能核酸酶几近失活,而SAN仍能保持较高活性。
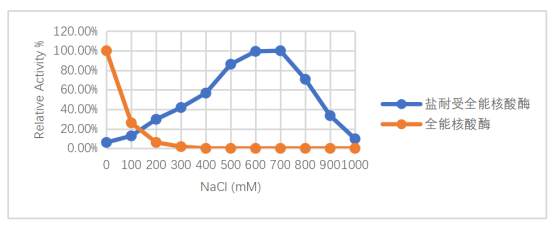
图1.不同盐浓度下耐高盐全能核酸酶(SAN)与初代全能核酸酶活性对比
2. 高效核酸降解力
同对照组相比,添加SAN后能够有效去除核酸残留。
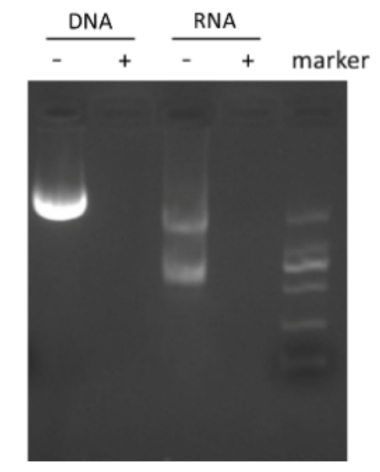
图2 加入SAN 前后的消化效果图
五,逐典耐高盐全能核酸酶用途
1.疫苗和病毒样品制备中高盐环境下DNA污染的去除
2.与细胞或细菌裂解液配合使用,去除粗提物中的核酸,降低溶液粘性,提高蛋白质产量。
3.减少存放的外周血单细胞(PBMC)的结块现象
4.降解核酸,利于不可溶性蛋白复性前高质量包涵体制备。
5.有效去除带负电荷的核酸对双向SDS-PAGE蛋白样品的影响,改善蛋白质分离效果,增强2-DE分辨率
六,客户应用案例





